Фтор. Бром. Йод
РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ VIIA ГРУПИ
§ 23. Фтор. Бром. Йод
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати та порівнювати властивості фтору, брому, йоду та їх сполук, практичне значення;
Складати рівняння, схеми електронного балансу відповідних хімічних реакцій;
Визначати експериментально галогенід-іони в розчинах та йод.
Фізичні властивості. Прості речовини фтор, бром, йод, як і хлор, складаються з двохатомних молекул з неполярним ковалентним зв’язком між атомами
Т а б л и ц я 6
Фізичні властивості галогенів
Речовина | Агрегатний стан за н. у. | Колір | Запах | Температура Плавлення, °С | Температура Кипіння, °С | |
Фтор F2 | 38 | Газ | Світло-жовтий | Різкий, Подразливий | -220 | -188 |
Бром Br2 | 160 | Рідина | Темно-бурий | Різкий, Смердючий | -7 | +58 |
Йод | 254 | Тверда Речовина | Сірувато – чорний з металічним блиском | Різкий | + 114 | +186 |
Про леткість галогенів свідчать наявність запаху, можливість твердого йоду при слабкому нагріванні, не плавлячись, перетворюватися на пару фіолетового кольору з різким запахом. При охолодженні пара знов осідає у вигляді кристалів (мал. 31).
Перехід речовин при нагріванні з твердого стану в газуватий і навпаки, оминаючи рідкий, називається сублімацією.
Таке явище характерне ще для деяких відомих вам речовин з молекулярною граткою, наприклад вуглекислого газу, нафталену.

Мал. 31. Сублімація йоду

Мал. 32. Йод (а), якісна реакція на йод з крохмалем (б), виявлення крохмалю в картоплі дією йодом (в)
Зі збільшенням молекулярної маси галогенів їх температури плавлення і кипіння підвищуються, зростає густина, посилюється інтенсивність забарвлення. Поява в йоді металічного блиску (мал. 32, а) відповідає закономірному посиленню металічних властивостей зі збільшенням атомного номера хімічних елементів однієї групи періодичної системи.
Бром і йод малорозчинні у воді, але добре розчиняються в органічних розчинниках (спирт). Рідина, яку називають у побуті йодом, насправді є спиртовим розчином йоду. Водні розчини брому та йоду, як і хлору, називають відповідно бромною та йодною водою. Їх формули – Br2 та I2, а колір майже однаковий – від слабкожовтого до темно-коричневого. Але йод легко розпізнати за допомоги крохмалю, з яким він утворює продукт темно-синього кольору. Крохмаль є реактивом на йод, а йод – реактивом на крохмаль (мал. 32, б, в). Фтор не утворює фторної води, оскільки реагує з водою із вибухом.
Хімічні властивості фтору, брому, йоду зумовлені здатністю їх атомів приєднувати один електрон до завершення останнього електронного шару і виявляти окиснювальну властивість:
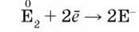
Окиснювальна здатність галогенів послаблюється від фтору до йоду: Фтор – найсильніший, а йод – найслабший окисник серед галогенів, бром дещо поступається хлору.
Поясніть причину послаблення окиснювальних властивостей галогенів.
Взаємодія з воднем. Фтор реагує з воднем із вибухом. Хлор, як ви пам’ятаєте, вибухає з воднем лише при освітленні, а в темряві реакція не відбувається. Для реакції водню з бромом і йодом потрібне нагрівання:
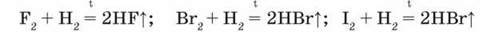
Продуктами реакцій є відповідно флуороводень, або фтороводень НF, бромоводень НВг, йодоводень НІ.
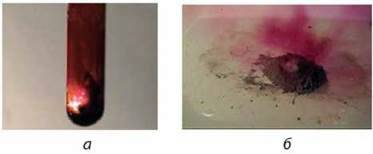
Мал. 33. Реакція алюмінію з: а – бромом; б – йодом
Взаємодія з металами завершується утворенням солей (пригадайте походження назви “галогени”). Так, фтор уже за звичайних умов реагує з більшістю металів, а при нагріванні – навіть з благородними металами (золотом, сріблом, платиною). Алюміній і цинк в атмосфері фтору спалахують.
Решта галогенів реагує з металами при нагріванні. Так, у парах брому горить алюміній (мал. 33, а). Йод окиснює метали повільніше, однак у присутності води як каталізатора реакції йоду з порошками алюмінію, магнію, цинку дуже бурхливі й супроводжуються появою фіолетової пари йоду (мал. 33, б):
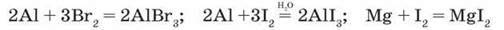
-Поясніть причину появи пари йоду.
Взаємодія з водою. У цій реакції окиснювальна активність галогенів також закономірно послаблюється від фтору до йоду. Так, у фторі вода горить, хоча відомо, що вода – негорюча речовина, нею гасять пожежі. Продуктами реакції є флуороводень і кисень:
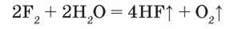
Зверніть увагу, Флуор витісняє Оксиген з молекули води. Це доводить, що фтор активніший окисник, ніж кисень.
– Складанням схеми електронного балансу доведіть правильність цього твердження.
Реакція хлору з водою, як вам відомо, відбувається лише на світлі. Бром і йод з водою не реагують.
Взаємодія з солями галогенів. Про послаблення окиснювальних і посилення відновних властивостей галогенів свідчать реакції, у яких галогени з меншим атомним номером витісняють галогени з більшим атомним номером, а саме: Хлор витісняє Бром та Іод, Бром – лише Іод, а Іод не здатний витіснити ні Бром, ні Хлор:
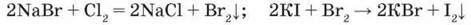
– Чому не можна проводити таку реакцію за наявності Флуору як у складі простої речовини, так і в складі флуориду?
Реакції між хлором і бромідами та іодидами застосовують у промисловості для добування брому та йоду.
Порівняльна характеристика галогеноводневих кислот. Як і хлороводень, усі галогеноводні, розчиняючись у воді, утворюють кислоти: флуоридну НF (плавикову, або фторидну), бромідну HBr, іодидну HI. Сила галогеноводневих кислот як електролітів збільшується в ряді: НF < НСl < HBr < НІ. Найсильніша з галогеноводневих кислот – іодидна, найслабша – фторидна.
Велика міцність хімічного зв’язку Н-F, за чого фторидна кислота слабко дисоціює у воді, зумовлена малим розміром атома Флуору і відповідно малою відстанню між ядрами Гідрогену та Флуору. Із збільшенням атомного номера галогенів від F до І зростає радіус їх атомів, збільшується відстань між атомами галогену та Гідрогену, а тому зменшується міцність зв’язку між ними і відповідно посилюється здатність до електролітичної дисоціації.
– Складіть рівняння дисоціації іодидної та флуоридної кислот.
Солі розглянутих галогеноводневих кислот називаються відповідно флуоридами (фторидами), бромідами, іодидами. Майже всі солі сильних бромідної та іодидної кислот, як і хлоридної, добре розчинні у воді. Серед практично нерозчинних у воді солей – галогеніди Аргентуму(І): AgC1, AgBr, AgI.
Навпаки, аргентум флуорид є розчинною сіллю. Хлориди, броміди, іодиди Аргентуму відрізняються за кольором: аргентум хлорид – білого, аргентум бромід – світло-жовтого; аргентум іодид – яскравожов – того кольору. Це використовують для розпізнавання галогенід-іонів у розчині за допомоги одного реактиву – аргентум нітрату AgNO3.
Застосування сполук Флуору, Брому, Іоду. Фтор використовують в атомній промисловості і ракетній техніці. З нього добувають флуоровуглеводні. Так, газ фреон, який містить сполуки дифлуородихлорометан ССl2F2 і трифлуорохлорометан CClF3, застосовують у холодильних установках. Тетрафлуороетилен FC=CF2 може по – лімеризуватися, утворюючи політетрафлуороетилен (-CF2-CF2-)n, або тефлон. Цей матеріал стійкий до дії більшості хімічних реагентів, його застосовують у хімічній промисловості, а також для виготовлення побутового посуду. Флуор входить до складу зубних паст, ліків. Плавикову кислоту застосовують для нанесення на скло малюнків, оскільки вона взаємодіє з силіцій(ІV) оксидом скла, тобто “плавить” його (звідси її назва):
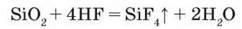
Для цього скло вкривають тонким шаром парафіну, наносять малюнок, а потім виріб занурюють у розчин плавикової кислоти. Під дією кислоти на склі залишається малюнок. Таким способом видатний литовський художник М. Чюрльоніс створив майже тридцять художніх творів, що зберігаються в музеї його імені в Каунасі.
Бром незамінний у виробництві фотоплівки. Фотографування засновано на розкладанні аргентум броміду під дією світла за рівнянням реакції:
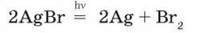
Чорне зображення на проявленій фотоплівці утворюють найдрібніші частинки металічного срібла. Натрій бромід застосовують як засіб, що заспокоює нервову систему.
Головним споживачем йоду є фармацевтична та хімічна промисловість. Його 5 – 10 %-вий спиртовий розчин (йодна настойка) використовують для обробки ран. Сучасним напрямом застосування галогенів є використання їх в енергозберігаючих лампах. У колбу лампи, крім інертних газів (аргону та азоту), додають пари галогенів – йоду або брому, що вдвічі підвищує її ефективність і в чотири рази довговічність.
Широке застосування сполук галогенів, а саме флуоро-, бромо-, хлорофреонів, супроводжується попередженням учених про можливість їх негативного впливу на озоновий шар Землі.
Коротко про головне
Прості речовини фтор, бром, йод є типовими неметалами. Молекулярна кристалічна гратка галогенів зумовлює їх леткість, низькі температури плавлення і кипіння. Зі збільшенням молекулярної маси галогенів закономірно змінюється їх агрегатний стан: від газуватого фтору до твердого йоду. Йод здатний до сублімації.
Як окиснювачі фтор, бром, йод взаємодіють з металами, воднем. У ряді F2, С12, Вг2, І2 окиснювальна здатність галогенів послаблюється, внаслідок чого галогени з меншим атомним номером витісняють із солей галогени з більшим атомним номером.
Водні розчини галогеноводнів є кислотами, сила яких посилюється від флуоридної до іодидної кислоти. Бромідна та іодидна кислоти, як і хлоридна, є сильними кислотами, флуоридна – слабкою.
Галогени та їх сполуки широко застосовують у виробництві сучасних матеріалів: полімерів, холодоагентів, фотоматеріалів, енергозберігаючих приладів.
