Гідратація іонів – РОЗЧИНИ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
§ 5.7. Гідратація іонів
Відомий російський хімік І. О. Каблуков довів, що електролітичну дисоціацію не можна пояснити без хімічної теорії розчинів Д. І. Менделєєва. Як відомо, Д. І. Менделєєв експериментально обгрунтував утворення хімічних сполук під час взаємодії розчиненої речовини з розчинником. Дійсно, під час розчинення відбувається хімічна взаємодія розчиненої речовини з водою, яка
Гідратовані іони містять як стале, так і змінне число молекул води. Гідрат сталого складу утворює іон гідрогену Н, що утримує одну молекулу води, – це гідратований протон Н (Н2О). У науковій літературі його зображують формулою
Слід пам’ятати, що в розчинах немає іона Н+, а є іон Н3О+, який іноді для спрощення умовно позначають символом Н+. Говорячи про іон гідрогену в розчинах, завжди мають на увазі іон гідроксонію.
1 Сольватація – хімічний зв’язок іонів з молекулами неводного розчинника.
Механізм виникнення міцного ковалентного зв’язку в іоні Н3О донорно-акцепторний:
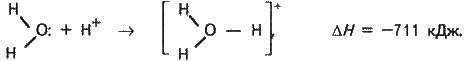
Молекула води – донор, протон – акцептор.
Однак думки хіміків розділились. Одні уважають, що в розчині існують тільки іони гідроксонію Н3О, а інші – що крім іона Н3О є також іони Н9О4 (які можна уявити як Н ∙ 4Н2O або Н3О -3Н2O) і Н7О3+ (Н+∙ 3Н2O або Н3О+∙ 2Н2О). Жодне з цих припущень експериментально не підтверджене. Більшість інших іонів також утворюють гідрати змінного складу. Тому краще зображувати іон гідрогену як Н (водн.), що означає гідратований іон гідрогену. Аналогічно слід поступати і при написанні інших гідратованих іонів. Наприклад:
НСl (газ) ⇆ Н+ (водн.) + Сl – (водн.);
СН3СООН (водн.) ⇆ Н+ (водн.) + СН3СОО – (водн.);
HSO4 (водн.) ⇆Н+ (водн.) + SO42- (водн.).
Проте, звичайно, для спрощення запису вказівки в дужках випускають.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Сильні й слабкі електроліти – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.10. Сильні й слабкі електроліти Розрізняють сильні й слабкі електроліти. Сильні електроліти під час розчинення у воді повністю дисоціюють на іони. До них належать: 1) майже всі солі; 2) багато мінеральних кислот, наприклад H2SO4, HNO3, […]...
- Механізм дисоціації – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.6. Механізм дисоціації Суттєвим є питання про механізм електролітичної дисоціації. І дійсно, чому електроліти дисоціюють на іони? Вчення про хімічний зв’язок атомів допомагає відповісти на це запитання. Найлегше дисоціюють речовини з іонним зв’язком. Як відомо, […]...
- Дія буферів – Буферні розчини – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.5. Буферні розчини Дія буферів Використовуючи константу рівноваги процесу дисоціації кислоти, можна показати дію буфера: – Додавання кислоти, тобто збільшення с(Н3О+). Для збереження рівноваги додані іони гідроксонію реагуватимуть з відповідними іонами А-, утворюючи недисоційовану НА, практично не змінюючи концентрацію іонів гідроксонію. – Додавання лугу, тобто збільшення с(ОН-). Додані гідроксид-іони […]...
- Дисоціація води – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.12. Дисоціація води. pH Водa і як слабкий електроліт незначною мірою дисоціює на іони Н+ і ОН-, що перебувають у рівновазі з недисоційованими молекулами: Н2O ⇆ Н+ + ОН-. Концентрацію іонів звичайно виражають у молях […]...
- Електроліти і неелектроліти – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.4. Електроліти і неелектроліти Добре відомо, що одні речовини в розчиненому або розплавленому вигляді проводять електричний струм, інші за таких самих умов струм не проводять. Це можна простежити за допомогою простого приладу (рис. 5.4). Він […]...
- Теорія електролітичної дисоціації – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.5. Теорія електролітичної дисоціації Для пояснення особливостей водних розчинів електролітів шведський учений С. Арреніус у 1887 р. запропонував теорію електролітичної дисоціації. Пізніше вона була розвинута багатьма вченими на основі вчення про будову атомів і хімічний […]...
- Дисоціація кислот, основ і солей у водних розчинах – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.8. Дисоціація кислот, основ і солей у водних розчинах За допомогою теорії електролітичної дисоціації дають означення й описують властивості кислот, основ і солей. Кислотами називаються електроліти, під час дисоціації яких як катіони утворюються тільки катіони […]...
- Поняття про розчини і розчинність – Розчини Хімія Загальна хімія Розчини Поняття про розчини і розчинність Розчини – однорідні системи, що складаються з двох і більше компонентів і продуктів їх взаємодії. Розчини належать до однорідних сумішеЙ. Так, водні розчини складаються з розчинника (води), розчиненої речовини Та продуктів їхньої взаємодії – гідратованих (сполучених з молекулами води) йоніВ. Розчинність – здатність речовини розчинятися у […]...
- Значення pH буферів – Буферні розчини – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.5. Буферні розчини Суміш слабкої кислоти і зв’язаної основи, або слабкої основи і її зв’язаної кислоти характеризується тим, що її водневий показник при додаванні не дуже великої кількості іонів гідроксонію або гідроксид-іонів практично не змінюється. Розчини, показник pH яких по відношенню до кислот і лугів залишається стабільним, називають буферними […]...
- Ступінь дисоціації – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.9. Ступінь дисоціації Оскільки електролітична дисоціація – процес оборотний, то в розчинах електролітів поряд з їх іонами є й молекули. Тому розчини електролітів характеризуються ступенем дисоціації (позначається грецькою буквою “альфа” а). Ступінь дисоціації – це […]...
- Кислоти – НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 6. НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК § 6.2. Кислоти Означення класу кислот з погляду теорії електролітичної дисоціації див. § 5.8. Наведені там приклади рівнянь їх дисоціації можна записати точніше, із урахуванням гідратації іонів: НСl (газ) ⇆Н+ (водн.) + Сl (водн.); СН3СООН (водн.) […]...
- Нейтралізація слабких кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація При змішуванні рівних об’ємів соляної кислоти і розчину їдкого натру однакових концентрацій, утворюється нейтральний розчин натрій хлориду, що має показник pH = 7. Таким чином, кислотні і лужні властивості початкових речовин нейтралізуються. Нейтралізація є реакцією взаємодії іонів гідроксонію і гідроксид-іонів з утворенням молекул води: Н3О+ + ОН – 2 Н2О. […]...
- Розв’язування типових задач Масова частка розчиненої речовини – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.14. Розв’язування типових задач Масова частка розчиненої речовини Задача 1. Потрібно приготувати розчин масою 320 г з масовою часткою хлориду калію 3%. Розрахуйте масу КСl і масу води, які необхідні для приготування розчину. Розв’язання. Обчислюємо […]...
- Стандартні ентальпія утворення й ентропія іонів у водних розчинах ДОДАТОК 3. Термодинамічні величини простих речовин і сполук. Стандартна ентальпія утворення ∆ Н f, 2 98 º I Ентропія S 298 º Стандартні ентальпія утворення й ентропія іонів у водних розчинах Іон (ag) ∆Нf,298º КДж/моль S298 º Дж/(моль ∙ К) Іон (ag) ∆Нf,298º КДж/моль S298 º Дж/(моль ∙ К) Ag+ 106 73 Cu+ 72 41 […]...
- Основи – НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 6. НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК § 6.3. Основи Визначення класу основ див. § 5.8. Наведені там приклади дисоціації основ точніше, із урахуванням гідратації іонів, слід писати так: КОН (к.) ⇆ К+ (водн.) + ОН – (водн.); NH3 ∙ Н2О1 ⇆NH+4 (водн.) […]...
- Ентальпія гідратації іонів при 25 °С ДОДАТОК 3. Термодинамічні величини простих речовин і сполук. Стандартна ентальпія утворення ∆ Н f, 2 98 º I Ентропія S 298 º Ентальпія гідратації ∆ H 0 гідр. іонів при 25 °С Іон ∆ H0гідр. КДж/моль Іон ∆ H0гідр. КДж/моль Іон ∆ H0гідр. КДж/моль Ag+ -489,53 F- -485,34 MnO4- -246,86 Ba2+ -1338,88 H+ -1108,76 NH4+ […]...
- Протолітична теорія кислот і основ – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.13. Протолітична теорія кислот і основ Теорія електролітичної дисоціації пояснила численні явища і процеси, що відбуваються у водних розчинах електролітів. Так, наприклад, у різних реакціях нейтралізації NaOH + НСl = NaCl + Н2O; КОН + […]...
- Теплові явища при розчиненні – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.3. Теплові явища при розчиненні Розчинення речовин супроводжується тепловим ефектом: виділенням або поглинанням теплоти – залежно від природи речовини. Під час розчинення у воді, наприклад, гідроксиду калію, сульфатної кислоти спостерігається сильне розігрівання розчину, тобто виділення […]...
- Структура карбонових кислот КЛАСИ ОРГАНІЧНИХ РЕЧОВИН 5 . Карбонові кислоти 5.2 . Структура карбонових кислот Карбонові кислоти дисоціюють у воді з утворенням іонів карбоксилату та іонів гідроксонію: Центральний атом Карбону подвійним зв’язком з’єднаний з атомом Оксигену, який знаходиться у sp2-гібридному стані, тому карбоксильна група має плоску структуру. Протон гідроксильної групи в карбонових кислотах на відміну від протона гідроксильної […]...
- Електроліз водних розчинів електролітів – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.7. Електроліз водних розчинів електролітів Слід розрізняти електроліз розплавлених електролітів і їх розчинів. В останньому випадку в процесах можуть брати участь молекули води. Як приклад розглянемо електроліз концентрованого водного розчину хлориду натрію (електроди вугільні). В цьому […]...
- СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ Якщо реакція речовини з водою, яка призводить до утворення іонів, не проходить до кінця і у розчині залишаються молекули вихідної речовини, тобто процес електролітичної дисоціації оборотний, то така речовина належить до слабких електролітів. Крім описаних у попередньому параграфі води й аміаку, до слабких електролітів належать майже […]...
- Поняття про розчини – РОЗЧИНИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ РОЗЧИНИ Поняття про розчини Розчини є одним із різновидів дисперсних систем (від лат. disperse – розсіювати, розсипати). Усі дисперсні системи складаються з дисперсійного середовища (розчинника) та дисперсної фази (розчиненої речовини). Залежно ж від того, в якому агрегатному стані й у якому ступені роздрібнення […]...
- Реакції іонного обміну – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.11. Реакції іонного обміну Згідно з теорією електролітичної дисоціації всі реакції у водних розчинах електролітів є реакціями між іонами. Вони називаються іонними реакціями, а рівняння цих реакцій – іонними рівняннями. Вони простіші, ніж рівняння реакцій, […]...
- Водневий показник – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.2. Водневий показник У водних розчинах електролітів (кислот, основ) іонний добуток води залишається практично незмінним, поки їх концентрація не стане дуже великою. Отже, якщо концентрація с(Н3О+) у розчині більша, ніж у чистій воді, то с(ОН-) повинна бути менша, і навпаки. Приклад. Рівновага НСl + Н2O Н3O+ + Сl – […]...
- Тема 11. Розчини – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Тема 11. Розчини Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Позначте речовину, що не розчинна у воді: A. Калій бромід; Б. Аргентум нітрат; B. Кальцій фосфат; Г. Натрій сульфат. 2. Вкажіть символ, яким позначається масова частка речовини: […]...
- КИСЛОТИ І ОСНОВИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ КИСЛОТИ І ОСНОВИ Загальним для всіх кислот при їх взаємодії з водою є утворення іона оксонію Н3O+ (саме цей іон, зокрема, викликає зміну забарвлення індикаторів), тому більш точне визначення класу речовин-кислот порівняно з тим, яке було подано раніше, таке: Кислотою називається речовина, яка при взаємодії з водою (при розчиненні у […]...
- ГІДРОСФЕРА. ВОДА У ПРИРОДІ Хімія – універсальний довідник ХІМІЯ І ХІМІЧНА ТЕХНОЛОГІЯ ХІМІЯ НАВКОЛИШНЬОГО СЕРЕДОВИЩА. ХІМІЧНА ЕКОЛОГІЯ. ГІДРОСФЕРА. ВОДА У ПРИРОДІ Вода – найбільш поширена сполука на Землі. Морська вода містить значну кількість розчинених речовин (1,5 – 1011 кг/м води). Найбільше іонів Сl – і Nа+, а також Мg2+, Са2+, К+, SO42-. Морська вода – джерело сировини для добування […]...
- Іонний добуток води – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага Рівновага, яка виникає в процесі протолізу, залежить від температури, хімічної природи реагентів і зміщується в бік утворення стійкіших сполук. 2.1. Іонний добуток води Молекула води, згідно теорії Бренстеда, може виступати як кислота або як основа. І навіть у чистій воді відбувається так званий автопротоліз (грец. autos – сам): Проте […]...
- ГІДРАТАЦІЯ Екологія – охорона природи ГІДРАТАЦІЯ – приєднання молекул води до молекул різних речовин, що перебувають у розчиненому чи у вільному стані. Г. відбувається з руйнуванням або без руйнування молекул води. Г. зумовлює розчинність речовин у воді, електролітичну дисоціацію йонних сполук. Г. – різновид сольватації....
- Якісне виявлення деяких іонів ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання ДОДАТКИ Додаток 9. Якісне виявлення деяких іонів Іон Реактив Рівняння реакції Характерні ознаки реакції К+ Виявлення у полум’ї При внесенні кристалика речовини у полум’я газового пальника, воно набуває… Бузкового кольору Na+ Жовтого кольору Са2+ Цегляно-червоного кольору Mg2+ Луги Утворюється білий аморфний осад NH4+ Луги (при нагріванні) З’являється […]...
- Добуток розчинності – Рівновага розчинності ХІМІЧНА РІВНОВАГА 3. Рівновага розчинності 3.2 . Добуток розчинності Якщо до насиченого розчину солі у воді ще додати цю ж сіль, то ця добавка випаде в нерозчинений осад. Якщо до нього додати сіль, що містить один з іонів розчиненої солі, то утвориться такий самий осад. Приклад. Якщо до насиченого розчину кальцій сульфату додати трохи кальцій […]...
- ВОДА У ПРИРОДІ. ОДЕРЖАННЯ ВОДИ – ВОДА. ВОДНІ РОЗЧИНИ Хімія – універсальний довідник ВОДА. ВОДНІ РОЗЧИНИ ВОДА У ПРИРОДІ. ОДЕРЖАННЯ ВОДИ Найважливіша сполука Гідрогену і Оксигену – вода Н2О. Її роль у процесах перетворення речовин як у живій, так і неживій природі величезна. Без перебільшення можна сказати, що практично всі хімічні перетворення на Землі відбуваються або з безпосередньою участю води, або у водних розчинах, […]...
- КОМПЛЕКСОУТВОРЕННЯ – ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ КОМПЛЕКСОУТВОРЕННЯ Комплексні іони складаються з центрального іона, зв’язаного зі здатними до самостійного існування молекулами або іонами: Координаційні сполуки: Комплексний іон 2+ має тетраедричну форму, а комплексний іон 4 – октаедричну (рис. 12). Рис. 12. Тетраедрична форма комплексного іона 2+ (а) і октаедрична форма комплексного іона 4- […]...
- Тема 12. Електролітична дисоціація – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Тема 12. Електролітична дисоціація Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Вкажіть речовину, за допомогою якої можна визначити сульфат-іони у розчині: A. Калій перманганат; Б. Лакмус; B. Барій нітрат; Г. Купрум(ІІ) гідроксид. 2. Позначте іони, що знаходяться […]...
- ГІДРОЛІЗ СОЛЕЙ – ВУГЛЕЦЬ І ЙОГО СПОЛУКИ Хімія – універсальний довідник ВУГЛЕЦЬ І ЙОГО СПОЛУКИ ГІДРОЛІЗ СОЛЕЙ У нейтральних розчинах, тобто за відсутності кислот і лугів, у результаті дисоціації (дуже слабкої) води утворюються однакові кількості іонів Н+ і ОН-: Додавання до води кислоти збільшує концентрацію іонів Н+ і, зміщуючи рівновагу дисоціації води вліво, знижує концентрацію іонів ОН-. Отже, кислий розчин містить більше […]...
- Розчинність. Кристалогідрати – РОЗЧИНИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ РОЗЧИНИ Розчинність. Кристалогідрати Розчинність – це властивість речовини розчинятися у воді або в якомусь іншому розчиннику. За розчинністю речовини поділяють на розчинні, малорозчинні й нерозчинні. Однак слід зазначити, що абсолютно нерозчинних речовин не існує. Будь-яка речовина, навіть така як скло чи золото, у […]...
- Чисельне вираження складу розчинів – РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.1. Чисельне вираження складу розчинів У природі й техніці розчини мають величезне значення. Рослини засвоюють речовини у вигляді розчинів. Засвоєння їжі пов’язане з переходом поживних речовин у розчин. Усі природні води є розчинами. Розчинами є […]...
- Проба розчином Фелінга – Виявлення альдегідів АНАЛІЗ ОРГАНІЧНИХ СПОЛУК 2 . Визначення властивостей речовин 2.2. Виявлення альдегідів Альдегіди в лужному розчині є сильними відновниками. При цьому карбонільна група окислюється в карбоксильну групу. Відновлення відповідних іонів металів є доказом наявності альдегідів. Проба розчином Фелінга Як реагент використовують розчин купрум(ІІ) сульфату. Іони Си(ІІ), що містяться в ньому, вступають у реакцію в лужному розчині […]...
- РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ У розчинах електролітів у хімічну взаємодію вступають іони. З’ясуємо, у яких випадках це відбувається. Якщо змішати водні розчини кухонної солі (хлориду натрію) і вапняної води (розчину гідроксиду кальцію), то зовнішніх змін не спостерігається. Формально можна написати З огляду на те, що всі чотири речовини (хлорид і […]...
- Узагальнення й систематизація знань з теми “Розчини” Тема 1 РОЗЧИНИ Урок 19 Тема уроку. Узагальнення й систематизація знань з теми “Розчини” Цілі уроку: узагальнити, систематизувати та скоригувати знання учнів з теми “Розчини”; з’ясувати рівень засвоєння знань, умінь і навичок про процеси, що протікають у розчинах, рівень розуміння основних понять, умінь використовувати їх на практиці. Тип уроку: узагальнення й систематизації знань, умінь і […]...