Ідеальний газ. Закони ідеального газу
ФІЗИКА
Частина 2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
Розділ 4 ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ ГАЗІВ
4.4. Ідеальний газ. Закони ідеального газу
При вивченні зміни стану важливо встановити зв’язок між різними величинами, що характеризують властивості речовини і називаються параметрами стану. Найважливішими з них є густина (або зв’язаний з нею питомий об’єм, що займає одиниця маси речовини), тиск і температура.
Рівняння, що зв’язує для певної маси речовини об’єм, тиск і температуру, називають термічним рівнянням

Найпростішого вигляду рівняння стану набирає для ідеального газу. Ідеальний газ – це фізична абстракція (модель), яка реально не існує, але з якою порівнюють реальні гази.
Під ідеальним газом розуміють такий газ, у якому частинки між собою на відстані не взаємодіють, а розмірами їх можна нехтувати, тобто вважати, що маса їх зосереджена в точці. Реальні гази поводять себе як ідеальний газ при високих температурах й малих тисках. Однак практично деякі гази навіть при атмосферному
Закон Бойля – Маріотта справедливий за сталої температури (ізотермічний процес):

Закон Гей-Люссака передає залежність об’єму газу від температури при сталому тиску (ізобарний процес):

Де α = 1/273 К-1 – термічний коефіцієнт об’ємного розширення.
Закон Шарля характеризує залежність тиску газу від температури при сталому об’ємі (ізохорний процес):

Аналізуючи рівняння (4.2)-(4.4), можна дістати об’єднаний газовий закон:
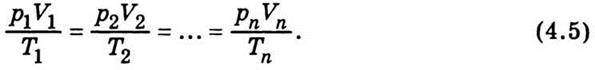
Фізичний зміст цієї формули такий: якщо помістити газ у закриту посудину, об’єм якої можна змінювати, наприклад у циліндр з поршнем, то при довільній зміні об’єму й температури тиск змінюватиметься так, що відношення добутку тиску на об’єм до абсолютної температури дорівнюватиме деякій сталій величині. Ця величина, як показує досвід, залежить від маси газу.
Для грам-моля будь-якого газу це відношення буде таким:

Де R – універсальна газова стала.
Рівняння (4.6) називають рівнянням Менделєєва – Клапейрона. Найбільш загальна форма цього рівняння для довільної маси газу m така:
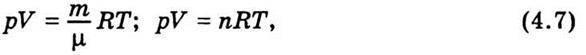
Де μ – молярна маса газу; n – число молів газу.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- РІВНЯННЯ СТАНУ ІДЕАЛЬНОГО ГАЗУ (РІВНЯННЯ КЛАПЕЙРОНА – МЕНДЕЛЄЄВА) – ВЛАСТИВОСТІ ГАЗІВ (ГАЗОВІ ЗАКОНИ) Фізика підготовка до ЗНО комплексне видання МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА 2. ВЛАСТИВОСТІ ГАЗІВ (ГАЗОВІ ЗАКОНИ) – Не зберігають ні форми, ні об’єму. – Характер молекулярного руху: безладний (хаотичний) рух. 2.1. РІВНЯННЯ СТАНУ ІДЕАЛЬНОГО ГАЗУ (РІВНЯННЯ КЛАПЕЙРОНА – МЕНДЕЛЄЄВА) Рівняння стану ідеального газу зв’язує макроскопічні параметри р, V, Т, які характеризують стан даної маси тіла. Рівняння […]...
- Розв’язування задач на рівняння стану ідеального газу ВЛАСТИВОСТІ ГАЗІВ, РІДИН, ТВЕРДИХ ТІЛ* Урок № 7 Тема. Розв’язування задач на рівняння стану ідеального газу Мета: сприяти глибокому розумінню величин, що характеризують стан термодинамічної системи, уміння використовувати отримані знання під час пояснення фізичних явищ, розвивати логічне мислення. ХІД УРОКУ I. Перевірка знань під час фронтального опитування 1. Що ми розуміємо під рівнянням стану газу? […]...
- Рівняння стану ідеального газу 2-й семестр МОЛЕКУЛЯРНА ФІЗИКА Й ТЕРМОДИНАМІКА 1. Властивості газів, рідин, твердих тіл Урок 8/79 Тема. Рівняння стану ідеального газу Мета уроку: одержати залежність між макроскопічними параметрами (р, V, Т), що характеризують стан газу Тип уроку: вивчення нового матеріалу План уроку Контроль знань 4 хв. 1. Основне рівняння молекулярно-кінетичної теорії ідеального газу. 2. Зв’язок тиску з […]...
- Внутрішня енергія і теплоємність ідеального газу ФІЗИКА Частина 2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА Розділ 4 ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ ГАЗІВ 4.6. Внутрішня енергія і теплоємність ідеального газу Оскільки молекули ідеального газу на відстані не взаємодіють, внутрішня енергія такого газу складається лише з кінетичних енергій окремих молекул. Тоді внутрішня енергія моля ідеального газу дорівнюватиме добутку числа Авогадро на середню кінетичну енергію однієї молекули: […]...
- ІДЕАЛЬНИЙ ГАЗ. ОСНОВНЕ РІВНЯННЯ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ ІДЕАЛЬНОГО ГАЗУ (РІВНЯННЯ КЛАУЗІУСА) Фізика підготовка до ЗНО комплексне видання МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА 1. ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ 1.5. ІДЕАЛЬНИЙ ГАЗ. ОСНОВНЕ РІВНЯННЯ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ ІДЕАЛЬНОГО ГАЗУ (РІВНЯННЯ КЛАУЗІУСА) Ідеальний газ – де газ, у якому середня відстань між молекулами набагато більша від розмірів молекул, і тому в ньому потенціальною енергією молекул нехтують (рис. 3). Рис. З Середня квадратична […]...
- Основне рівняння МКТ ідеального газу 2-й семестр МОЛЕКУЛЯРНА ФІЗИКА Й ТЕРМОДИНАМІКА 1. Властивості газів, рідин, твердих тіл Урок 7/78 Тема. Основне рівняння МКТ ідеального газу Мета уроку: з’ясувати механізм тиску ідеального газу і його залежність від мікропараметрів Тип уроку: вивчення нового матеріалу План уроку Контроль знань 5 хв. 1. Закон Гей-Люсака. 2. Закон Шарля. 3. Закон Бойля-Маріотта. 4. Графіки ізопроцесів […]...
- Розв’язування задач за темою “Рівняння стану ідеального газу” 2-й семестр МОЛЕКУЛЯРНА ФІЗИКА Й ТЕРМОДИНАМІКА 1. Властивості газів, рідин, твердих тіл Урок 9/80 Тема. Розв’язування задач за темою “Рівняння стану ідеального газу” Мета уроку: закріпити знання учнів про рівняння стану ідеального газу; познайомити учнів з методом поелементного розв’язування задач Тип уроку: закріплення знань РЕКОМЕНДАЦІЇ ЩОДО ПРОВЕДЕННЯ УРОКУ Засвоєнню й закріпленню знань під час розв’язування […]...
- ЗАКОН ГЕЙ-ЛЮССАКА (ІЗОБАРНИЙ ПРОЦЕС) – ВЛАСТИВОСТІ ГАЗІВ (ГАЗОВІ ЗАКОНИ) Фізика підготовка до ЗНО комплексне видання МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА 2. ВЛАСТИВОСТІ ГАЗІВ (ГАЗОВІ ЗАКОНИ) 2.2. ГАЗОВІ ЗАКОНИ 2.2.2. ЗАКОН ГЕЙ-ЛЮССАКА (ІЗОБАРНИЙ ПРОЦЕС) Ізобарний процес описується законом Гей-Люссака: для даної маси газу відношення об’єму і температури є сталим, якщо тиск газу не змінюється: Закон Гей-Люссака можна подати у вигляді Де t – температура за міжнародною […]...
- РОБОТА ІДЕАЛЬНОГО ГАЗУ. ЇЇ ГЕОМЕТРИЧНЕ ТЛУМАЧЕННЯ – ВНУТРІШНЯ ЕНЕРГІЯ І ЇЇ ЗМІНА ПРИ ТЕПЛОПЕРЕДАЧІ ТА ВИКОНАННІ РОБОТИ Фізика підготовка до ЗНО комплексне видання МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА 6. ОСНОВИ ТЕРМОДИНАМІКИ 6.1. ВНУТРІШНЯ ЕНЕРГІЯ І ЇЇ ЗМІНА ПРИ ТЕПЛОПЕРЕДАЧІ ТА ВИКОНАННІ РОБОТИ 6.1.2. РОБОТА ІДЕАЛЬНОГО ГАЗУ. ЇЇ ГЕОМЕТРИЧНЕ ТЛУМАЧЕННЯ Термодинамічна робота виконується тілами при зміні їхнього об’єму. Оскільки тверді й рідкі тіла при нагріванні розширюються незначною мірою, то незначною є і виконувана ними […]...
- ЗАКОН ШАРЛЯ (ІЗОХОРНИЙ ПРОЦЕС) – ВЛАСТИВОСТІ ГАЗІВ (ГАЗОВІ ЗАКОНИ) Фізика підготовка до ЗНО комплексне видання МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА 2. ВЛАСТИВОСТІ ГАЗІВ (ГАЗОВІ ЗАКОНИ) 2.2. ГАЗОВІ ЗАКОНИ 2.2.3. ЗАКОН ШАРЛЯ (ІЗОХОРНИЙ ПРОЦЕС) Ізохорний процес описується законом Шарля: для даної маси газу відношення тиску до температури є сталим, якщо об’єм не змінюється: Закон Шарля можна подати у вигляді: Де р – тиск газу при температурі […]...
- ВНУТРІШНЯ ЕНЕРГІЯ ІДЕАЛЬНОГО ГАЗУ – ВНУТРІШНЯ ЕНЕРГІЯ І ЇЇ ЗМІНА ПРИ ТЕПЛОПЕРЕДАЧІ ТА ВИКОНАННІ РОБОТИ Фізика підготовка до ЗНО комплексне видання МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА 6. ОСНОВИ ТЕРМОДИНАМІКИ 6.1. ВНУТРІШНЯ ЕНЕРГІЯ І ЇЇ ЗМІНА ПРИ ТЕПЛОПЕРЕДАЧІ ТА ВИКОНАННІ РОБОТИ 6.1.1. ВНУТРІШНЯ ЕНЕРГІЯ ІДЕАЛЬНОГО ГАЗУ Внутрішня енергія ідеального газу обумовлюється лише кінетичною енергією руху молекул; потенціальною енергією їх взаємодії можна знехтувати. Для ідеального газу масою m внутрішня енергія обчислюється за формулою […]...
- Газові закони. Закон Авогадро. Молярний об’єм газу ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ § 1.11. Газові закони. Закон Авогадро. Молярний об’єм газу Оскільки гази є найпростішим об’єктом для дослідження, то їх властивості й реакції між газуватими речовинами вивчено найповніше. Французький учений Ж. Л. Гей-Люссак встановив закон об’ємних відношень: […]...
- Тиск газу – Гідростатика та аеростатика 5. Механіка 5.5. Гідро – та аеростатика 5.5.2. Тиск газу Тиск газу при постійній температурі залежить від його густини. Із збільшенням температури тиск газу збільшується. Із збільшенням об’єму газу його тиск зменшується, а із зменшенням об’єму – збільшується....
- Ідеальний газ. Основне рівняння МКТ ВЛАСТИВОСТІ ГАЗІВ, РІДИН, ТВЕРДИХ ТІЛ* Урок № 5 Тема. Ідеальний газ. Основне рівняння МКТ Мета: ознайомити учнів із рівнянням, що описує властивості речовин у газоподібному стані. План уроку 1. Модель ідеального газу. 2. Тиск газу в МКТ. 3. Основне рівняння МКТ ідеального газу. ХІД УРОКУ I. Актуалізація опорних знань 1. Як сили взаємодії між молекулами […]...
- Робота термодинамічної системи ФІЗИКА Частина 2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА Розділ 7 ОСНОВИ ТЕРМОДИНАМІКИ 7.2. Робота термодинамічної системи Нехай газ міститься в циліндрі з легко-рухомим поршнем. Пісок, насипаний на поршень, підтримує його в рівновазі. При цьому газ перебуває під тиском р = , де F – вага піску і поршня; s – площа поршня. Якщо підвищити температуру газу […]...
- ЗАКОН БОЙЛЯ-МАРІОТТА (ІЗОТЕРМІЧНИЙ ПРОЦЕС) – ВЛАСТИВОСТІ ГАЗІВ (ГАЗОВІ ЗАКОНИ) Фізика підготовка до ЗНО комплексне видання МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА 2. ВЛАСТИВОСТІ ГАЗІВ (ГАЗОВІ ЗАКОНИ) 2.2. ГАЗОВІ ЗАКОНИ 2.2.1. ЗАКОН БОЙЛЯ-МАРІОТТА (ІЗОТЕРМІЧНИЙ ПРОЦЕС) Ізотермічний процес описується законом Бойля-Маріотта: для даної маси газу добуток тиску газу на його об’єм є сталим, якщо температура газу не змінюється: Ізотерма – графік залежності між параметрами даної маси газу за […]...
- МОЛЯРНИЙ ОБ’ЄМ ГАЗУ – ГАЗОПОДІБНИЙ СТАН РЕЧОВИНИ Хімія – універсальний довідник ГАЗОПОДІБНИЙ СТАН РЕЧОВИНИ МОЛЯРНИЙ ОБ’ЄМ ГАЗУ Найважливішим для хімії наслідком із закону Авогадро є уявлення про молярний об’єм газів. Згадаємо, що таке моль для речовин, які складаються з молекул. Моль – кількість речовини, що містить число молекул, рівне числу Авогадро NA (6,02 – 1023). Отже, на підставі закону Авогадро дійдемо висновку, […]...
- Закон Бернуллі – Гідростатика та аеростатика 5. Механіка 5.5. Гідро – та аеростатика 5.5.12. Закон Бернуллі Тиск рідини, що тече в трубі, більший у тій частині труби, де швидкість рідини менша і, навпаки, у частині труби, де швидкість рідини більша,- тиск менший. Рівняння Д. Бернуллі виведені ним у 1738 році: Фізичний зміст рівняння полягає в тому, що під час протікання ідеального […]...
- Рівняння стану – Газові закони ДОДАТОК 2 . Газові закони Стан ідеальних тазів1 і їхні взаємодії можна описати простими законами. Рівняння стану Взаємозв’язок між об’ємом V, тиском р і абсолютною температурою Т порції газу: = const об’єднаний газовий закон Для Т1 = Т2 = const (при сталій температурі): P1 ∙ V1 = р2 ∙ V2 закон Бойля-Маріотта Для p1 = […]...
- ТЕСТ 4. ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ Фізика підготовка до ЗНО комплексне видання МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА ТЕСТ 4. ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ Завдання 1-14 мають чотири варіанти відповідей, із яких тільки одна відповідь є правильною. Виберіть правильну, на вашу думку, відповідь 1. У балоні міститься 6 моль газу. Скільки молекул цього газу міститься в балоні? 2. У балоні міститься 3∙1023 молекул газу. […]...
- Газові закони 2-й семестр МОЛЕКУЛЯРНА ФІЗИКА Й ТЕРМОДИНАМІКА 1. Властивості газів, рідин, твердих тіл Урок 4/75 Тема. Газові закони Мета уроку: встановити залежність між двома макропараметрами газу за незмінного третього Тип уроку: вивчення нового матеріалу План уроку Демонстрації 5 хв. 1. Залежність тиску від об’єму за постійної температури. 2. Залежність об’єму газу від температури за постійного тиску. […]...
- Ізопроцеси в газах ВЛАСТИВОСТІ ГАЗІВ, РІДИН, ТВЕРДИХ ТІЛ* Урок № 8 Тема. Ізопроцеси в газах Мета: встановити кількісні залежності між двома параметрами газу за фіксованим значенням третього параметра. Обладнання: закритий гофрований циліндр змінного об’єму, з’єднаний із манометром. План уроку 1. Поняття ізопроцесів. 2. Ізотермічний процес. Закон Бойля-Маріотта. Як формулюється і записується цей закон? Графіки процесу. 3. Ізобарний процес. […]...
- Розв’язування задач на газові закони ВЛАСТИВОСТІ ГАЗІВ, РІДИН, ТВЕРДИХ ТІЛ* Урок № 9 Тема. Розв’язування задач на газові закони Мета: сприяти глибшому розумінню фізичних величин, що характеризують газові закони поглиблювати і систематизувати знання з основних положень МКТ, розвивати логічне мислення. ХІД УРОКУ І. Актуалізація опорних знань 1. Сформульований закон Бойля-Маріотта, записаний на дошці. 2. Який процес називається ізобаричним? Який газовий […]...
- Закон Авогадро. Молярний об’єм газу. Об’ємні співвідношення газів у реакціях ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина 1.8. Закон Авогадро. Молярний об’єм газу. Об’ємні співвідношення газів у реакціях Італійський учений А. Авогадро звернув увагу на те, що всі гази однаково стискуються (закон Бойля – Маріотта1), мають однаковий термічний коефіцієнт розширення (закон Гей-Люссака2) та деякі інші […]...
- Реальний газ. Рівняння стану реального газу ФІЗИКА Частина 2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА Розділ 4 ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ ГАЗІВ 4.9. Реальний газ. Рівняння стану реального газу Досвід засвідчує, що закони, які характеризують ідеальний газ, у першому наближенні можна застосовувати до розріджених реальних газів. Для реальних газів з помірною та великою густиною відхилення від законів ідеального газу значні. Для багатьох реальних газів […]...
- Тема 3. Газові закони. Закон Авогадро – ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Тема 3. Газові закони. Закон Авогадро Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Позначте формулювання закону Авогадро: A. Об’єми газуватих речовин в хімічній реакції пропорційні їхнім масам; Б. В однакових об’ємах різних […]...
- Розв’язування задач на основне рівняння МКТ ВЛАСТИВОСТІ ГАЗІВ, РІДИН, ТВЕРДИХ ТІЛ* Урок № 6 Тема. Розв’язування задач на основне рівняння МКТ Мета: сприяти глибшому розумінню понять, що характеризують основне рівняння МКТ, удосконалювати навички розв’язування задач. ХІД УРОКУ І. Актуалізація опорних знань 1. Сформувати й записати на дошці основне рівняння МКТ що встановлює зв’язок між тиском молекул на стінки посудини та мікроскопічними […]...
- ЗАКОН ДАЛЬТОНА – ВЛАСТИВОСТІ ГАЗІВ (ГАЗОВІ ЗАКОНИ) Фізика підготовка до ЗНО комплексне видання МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА 2. ВЛАСТИВОСТІ ГАЗІВ (ГАЗОВІ ЗАКОНИ) 2.3. ЗАКОН ДАЛЬТОНА Закон Дальтона: тиск суміші газів дорівнює сумі парціальних тисків складових газів: Парціальний тиск – це тиск, який створював би газ, якби він займав даний об’єм сам....
- ДЕЯКІ ФІЗИЧНІ ВЕЛИЧИНИ І ЇХ ОДИНИЦІ – ЗАКОНИ ЗБЕРЕЖЕННЯ. СТЕХІОМЕТРІЯ Хімія – універсальний довідник ЗАКОНИ ЗБЕРЕЖЕННЯ. СТЕХІОМЕТРІЯ У хімічних реакціях атоми не утворюються заново і не руйнуються. Цей факт відображають закони стехіометрії. Маса речовин, які вступили в хімічну реакцію, дорівнює масі речовин, які утворилися в результаті реакції (закон збереження маси). Об’єми газів, що реагують, відносяться один до одного і до об’єму отриманих газів як прості […]...
- ЗАКОН АВОГАДРО – ГАЗОПОДІБНИЙ СТАН РЕЧОВИНИ Хімія – універсальний довідник ГАЗОПОДІБНИЙ СТАН РЕЧОВИНИ ЗАКОН АВОГАДРО Об’єм деякої порції газу залежить від кількості молекул у ній (тобто, від кількості речовини), зовнішнього тиску і температури і не залежить від природи газу. Звідси випливає висновок, зроблений на початку минулого століття А. Авогадро, що дістав назву закону Авогадро: В однакових об’ємах різних газів за однакових […]...
- Молярний об’єм газів. Обчислення об’єму газу за нормальних умов Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 7 Тема. Молярний об’єм газів. Обчислення об’єму газу за нормальних умов Цілі уроку: ознайомити учнів з поняттям “молярний об’єм”; розкрити особливості використання поняття “молярний об’єм” для газоподібних речовин; навчити учнів використовувати отримані знання для розрахунків об’ємів газів за нормальних умов. Тип уроку: комбінований. Форми роботи: розповідь […]...
- Розподіл молекул газу за швидкостями. Закон Максвелла ФІЗИКА Частина 2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА Розділ 4 ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ ГАЗІВ 4.7. Розподіл молекул газу за швидкостями. Закон Максвелла У рівноважному стані параметри газу залишаються незмінними, проте мікростани – взаємне розташування молекул, їхні швидкості – безперервно змінюються. Оскільки всі напрями руху рівноймовірні, розподіл молекул за напрямом буде рівномірним. Швидкості молекул становлять від нуля […]...
- Адіабатичний процес. Рівняння адіабати ФІЗИКА Частина 2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА Розділ 7 ОСНОВИ ТЕРМОДИНАМІКИ 7.5. Адіабатичний процес. Рівняння адіабати Адіабатичним називають такий процес, який відбувається без теплообміну системи з навколишнім середовищем. Для здійснення адіабатичного процесу треба оточити систему такою оболонкою, яка не пропускає теплоти, але заважає тому, щоб система виконувала роботу або робота виконувалась над системою. Таку оболонку […]...
- Ізопроцеси – МОЛЕКУЛЯРНА ФІЗИКА Формули й таблиці ФІЗИКА МОЛЕКУЛЯРНА ФІЗИКА Відносна молекулярна маса Mr – відносна молекулярна маса; M0 – маса молекули даної речовини, ; M0с – маса молекули вуглецю, . Кількість речовини ν – кількість речовини, ; N – число молекул; Na – число Авогадро, NA = 6,02 · 1023 моль-1. Молярна маса М – молярна маса, . […]...
- Атомно-молекулярне вчення. Закони збереження маси речовин, сталості складу речовин – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.2. Атомно-молекулярне вчення. Закони збереження маси речовин, сталості складу речовин Атомно-молекулярне вчення – це сукупність аксіом і законів, що розглядають речовину, яка складається з атомів. Ось основні його положення: – усі речовини складаються з атомів. Молекули простих речовин складаються з […]...
- Визначення молярної маси – Визначення формули АНАЛІЗ ОРГАНІЧНИХ СПОЛУК 1.3 . Визначення молярної маси У газах і рідинах, що легко випаровуються, використовують основну залежність, яка полягає в тому, що 1 моль речовини в газоподібному стані за нормальних умов займає об’єм V = 22,4 літра. Зважена порція речовини леткої рідини випаровується, а об’єм газу, який утворився, вимірюють за наявної температури і тиску, […]...
- ФІЗИЧНІ ВЛАСТИВОСТІ КИСНЮ – КИСЕНЬ Хімія – універсальний довідник КИСЕНЬ ФІЗИЧНІ ВЛАСТИВОСТІ КИСНЮ Кисень – газ, що складається з двохатомних молекул кисню. Не має запаху і кольору. Густина кисню при 0 °С і тиску 1 атм (101,325 кПа) складає 1,43 г/л, що в 1,11 раза більше густини повітря (зверніть увагу: коли наводимо значення густини газу, обов’язково варто вказати температуру і […]...
- ПРАКТИЧНА РОБОТА № 1 “ДОБУВАННЯ ВУГЛЕКИСЛОГО ГАЗУ. ВЗАЄМОПЕРЕТВОРЕННЯ КАРБОНАТІВ I ГІДРОГЕНКАРБОНАТІВ” ТЕМА 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ УРОК 13. ПРАКТИЧНА РОБОТА № 1 “ДОБУВАННЯ ВУГЛЕКИСЛОГО ГАЗУ. ВЗАЄМОПЕРЕТВОРЕННЯ КАРБОНАТІВ I ГІДРОГЕНКАРБОНАТІВ” Цілі: повторити й закріпити знання про способи добування вуглекислого газу в лабораторних умовах, властивість вуглекислого газу взаємодіяти з розчинами лугів, взаємоперетворення карбонатів і гідрогенкарбонатів; формувати вміння виконувати хімічний експеримент, складати звіт про роботу; розвивати вміння […]...
- Розв’язування задач на графіки ізопроцесів 2-й семестр МОЛЕКУЛЯРНА ФІЗИКА Й ТЕРМОДИНАМІКА 1. Властивості газів, рідин, твердих тіл Урок 6/77 Тема. Розв’язування задач на графіки ізопроцесів Мета уроку: повторити, поглибити й закріпити знання учнів про газові закони під час розв’язування графічних завдань Тип уроку: закріплення знань РЕКОМЕНДАЦІЇ ЩОДО ПРОВЕДЕННЯ УРОКУ Засвоєнню й закріпленню знань під час розв’язування задач на графіки ізопроцесів […]...
- Основні фізичні величини, які використовують у хімії Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ ЗАКОНИ Й ПОНЯТТЯ ХІМІЇ Основні фізичні величини, які використовують у хімії У хімії використовують такі фізичні величини: маса, об’єм, кількість речовини, густина, атомна маса, відносна атомна й молекулярна маса, молярна маса, молярний об’єм, відносна густина газів, тиск, температура, час, концентрація, швидкість хімічної […]...