Ізопроцеси в газах
ВЛАСТИВОСТІ ГАЗІВ, РІДИН, ТВЕРДИХ ТІЛ*
Урок № 8
Тема. Ізопроцеси в газах
Мета: встановити кількісні залежності між двома параметрами газу за фіксованим значенням третього параметра.
Обладнання: закритий гофрований циліндр змінного об’єму, з’єднаний із манометром.
План уроку
1. Поняття ізопроцесів.
2. Ізотермічний процес. Закон Бойля-Маріотта. Як формулюється і записується цей закон? Графіки процесу.
3. Ізобарний процес. Закон Гей-Люссака. Як формулюється та записується цей закон? Графіки процесу.
4. Ізохорний
ХІД УРОКУ
I. Актуалізація опорних знань
1. Що таке термодинамічні параметри (термодинамічна система)?
2. Вивести рівняння стану ідеального газу (або рівняння Клапейрона-Мендєлєєва) із основного рівняння МКТ.
II. Вивчення нового матеріалу
1. За допомогою рівняння стану ідеального газу (рівняння Клапейрона-Мендєлєєва) можна дослідити процеси, у яких маса і один і термодинамічних параметрів р, V або Т – залишаються незмінними.
Процес – це перехід термодинамічної системи з одного стану в інший.
Кількісні
Процеси, які відбуваються за незмінного значення одного із параметрів ідеального газу, сталої маси тп і певного виду цього газу М, називаються ізопроцесами.
Розглянемо такі ізопроцеси.
2. Ізотермічний процес (m = const, М = const, Т = const). Процес зміни стану термодинамічної системи за сталої температури називається ізотермічним.
Якщо до ізометричного процесу застосувати рівняння Клапейрона-Мендєлєєва для двох процесів з урахуванням сталої температури Т1 = Т2, то отримаємо, що Р1V1 = Р2V2 або pV = const.
Цей закон можна сформулювати так: для деякої маси газу добуток тиску газу на об’єм за Т = const є сталою величиною.
Закон було встановлено експериментально англійським вченим Бойлем і французом Маріоттом і називається законом Бойля-Маріотта.
Цей закон справедливий для будь-яких газів, які можна вважати ідеальними, а також для їх сумішей.
Графічну залежність тиску від об’єму за умови Т = const можна зобразити у вигляді кривої – ізотерми в координатах р, V і прямих ліній у координатах p, Т або V, Т.
Ізотермічним можна вважати процес стиснення повітря компресором або розширення під поршнем насоса газу внаслідок відкачування його з посудини.
Закон Бойля-Маріотта можна перевірити експериментально за допомогою закритого гофрованого циліндра змінного об’єму, який з’єднаний гумовим шлангом з манометром.
3. Ізобарний процес (т = const, М = const, р = const).
Процес зміни стану термодинамічної системи за сталого тиску називається ізобарним.
Рівняння Клапейрона-Менделєєва набуде такого вигляду:
Закон Гей-Люссака читається так: для даної маси газу відношення об’єму до температури стале, якщо тиск газу не змінюється. Закон Гей-Люссака експериментально встановлений французьким ученим Гей-Люссаком.
Графік залежності об’єму від температури за сталого тиску є прямою лінією, яку називають ізобарою.
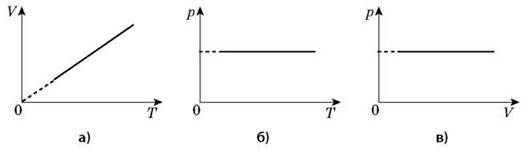
На інших координатах рТ, pV наведено графіки ізобарного процесу.
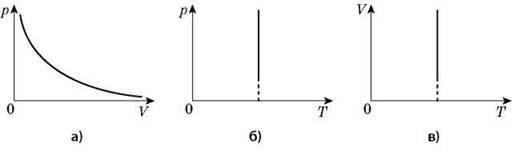
4. Ізохорний процес (m = const, М = const, V = const).
Процес зміни стану термодинамічної системи за сталого об’єму називається ізохорним.
Для ізохорного процесу рівняння Клапейрона-Менделєєва буде таким:
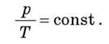
Читається так: для даної маси газу відношення тиску до температури стале, якщо об’єм газу не змінюється.
Цей закон було встановлено експериментально французом Шарлем і називається законом Шарля.
Графіком залежності тиску від температури за сталого об’єму є пряма лінія, яку називають ізохорою.
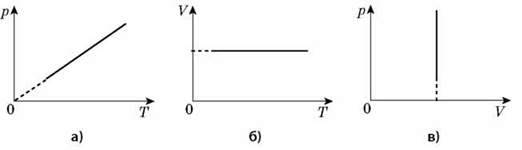
У координатах рТ зображена ізохора, в інших координатах VТ; pV – графіки ізохор.
III. Закріплення вивченого матеріалу
Газові закони і їх графічні ілюстрації дозволяють вивчити довільні термодинамічні процеси з ідеальним газом.
Наприклад, як встановити, нагрівається чи охолоджується газ під час переходу з стану 1 в стан 2?
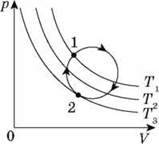
Для того щоб це визначити, проводять декілька ізотерм – Т1, Т2, Т3. Газ охолоджується, бо ізотерма Т3 знаходиться нижче ізотерми Т1.
IV. Домашнє завдання
Вивчити конспект.
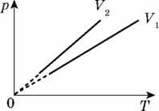
Задача, На р-Т діаграмі зображено два ізохорні процеси в ідеальному газі для об’ємів V1 і V2. Який об’єм більший? Маса газів однакова.