КИСЛОТИ І ОСНОВИ – ЕЛЕКТРОЛІТИ
Хімія – універсальний довідник
ЕЛЕКТРОЛІТИ
КИСЛОТИ І ОСНОВИ
Загальним для всіх кислот при їх взаємодії з водою є утворення іона оксонію Н3O+ (саме цей іон, зокрема, викликає зміну забарвлення індикаторів), тому більш точне визначення класу речовин-кислот порівняно з тим, яке було подано раніше, таке:
Кислотою називається речовина, яка при взаємодії з водою (при розчиненні у воді) утворює іони оксонію Н3O+ (або, опускаючи молекулу води-розчинника, іони Гідрогену Н+).
Реакція речовини з водою може відбуватися й інакше. Вода може
Цей же іон з’являється у розчині гідроксидів металів, тобто основ. Процес, що відбувається при їх розчиненні у воді, записується так:
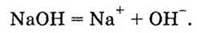
Загальним для всіх основ є наявність у їх водних розчинах гідроксид-іону ОН – (саме він змінює колір індикаторів). Звідси випливає визначення класу речовин-основ:
Основою називається речовина, яка при взаємодії з водою (при розчиненні у воді) утворює гідроксид-іони ОН-.
Таким чином, при взаємодії
І в чистій воді відбувається реакція
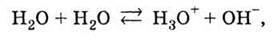
В якій одночасно утворюються і іон Н3O+, що визначає належність речовини до класу кислот, і іон ОН-, який утворюють основи. Подібні речовини називаються амфолітами.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Розвиток понять “кислоти” й “основи” – Визначення кислот і основ КИСЛОТИ Й ОСНОВИ 1. Визначення кислот і основ Кислотами зазвичай вважають речовини, водні розчини яких мають такі властивості: – кислий смак; – розчиняють неблагородні метали, виділяючи водень; – розкладають карбонати (наприклад, вапняк) з виділенням карбон діоксиду; – змінюють забарвлення індикаторів. До основ відносяться речовини, водні розчини яких (луги) мають такі властивості: – мильні на дотик; […]...
- Сильні кислоти й основи – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Силу кислоти або основи, за Бренстедом, визначають здатністю до протолізу, що залежить від того, як сильно виражена готовність речовини віддавати або приймати протони. Реагент визначає, яку функцію – кислоти чи основи – виконує речовина в реакції. У цьому випадку важливим реагентом є вода, оскільки […]...
- ОСНОВИ ЯК ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ ОСНОВИ ЯК ЕЛЕКТРОЛІТИ Існує дві групи основ: розчинні у воді луги і нерозчинні. Луги є сильними електролітами, в їх розчинах молекул гідроксидів немає. Нерозчинні основи (насправді практично нерозчинні) – слабкі електроліти. Слабким електролітом є гідроксид амонію NH4ОН, який існує тільки у розчині і є сполукою молекули аміаку з молекулою води […]...
- ВЗАЄМОДІЯ ВОДИ З ОКСИДАМИ. ПОНЯТТЯ ПРО ОСНОВИ, КИСЛОТИ, ІНДИКАТОРИ ДОСЛІДЖУЄМО НА УРОЦІ ТА ВДОМА ЛАБОРАТОРНИЙ ДОСЛІД 6 Випробування водних розчинів кислот і лугів індикаторами Речовини та обладнання: пробірки, штатив для пробірок, вода, натрій гідроксид, станова кислота, індикатори. Завдання 1. Користуючись індикаторами, перевіримо, як змінюються їх кольори у воді, водних розчинах кислоти і лугу. Для цього налили в першу пробірку 1 мл води, у другу […]...
- ЕЛЕКТРОЛІТИ І НЕЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ ЕЛЕКТРОЛІТИ І НЕЕЛЕКТРОЛІТИ Речовини, які мають іонну електропровідність, називаються електролітами. Усі інші речовини називаються неелектролітами. Електроліти – складні речовини, що складаються з іонів – позитивних і негативних, причому ці іони повинні володіти здатністю до переміщення в речовині. Таким чином, для того, щоб розпізнати, чи є дана рідина-неметал (тверда, рідка, розчин) […]...
- Основи – НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 6. НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК § 6.3. Основи Визначення класу основ див. § 5.8. Наведені там приклади дисоціації основ точніше, із урахуванням гідратації іонів, слід писати так: КОН (к.) ⇆ К+ (водн.) + ОН – (водн.); NH3 ∙ Н2О1 ⇆NH+4 (водн.) […]...
- Електроліти і неелектроліти – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.4. Електроліти і неелектроліти Добре відомо, що одні речовини в розчиненому або розплавленому вигляді проводять електричний струм, інші за таких самих умов струм не проводять. Це можна простежити за допомогою простого приладу (рис. 5.4). Він […]...
- СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ Якщо реакція речовини з водою, яка призводить до утворення іонів, не проходить до кінця і у розчині залишаються молекули вихідної речовини, тобто процес електролітичної дисоціації оборотний, то така речовина належить до слабких електролітів. Крім описаних у попередньому параграфі води й аміаку, до слабких електролітів належать майже […]...
- КИСЛОТИ ЯК ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ КИСЛОТИ ЯК ЕЛЕКТРОЛІТИ Властивості кислот можуть бути поділені на три групи. Перша група об’єднує загальні властивості кислот, зумовлені наявністю в їхніх розчинах іонів Гідрогену. Це – зміна забарвлення індикаторів, смак, взаємодія з металами, які стоять в ряді напруг металів лівіше Гідрогену, з основними оксидами, лугами, основами. Наведемо відповідні скорочені іонні […]...
- Розв’язування типових задач Оксиди, кислоти, основи, солі – НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 6. НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК § 6.7. Розв’язування типових задач Оксиди, кислоти, основи, солі Задача 1. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення; CuSO4 -> Сu -> СuО -> СuСl2 -> Сu(OН)2 -> Cu(OH)NO3 -> Сu(NO3)2. Розв’язання. 1) […]...
- СОЛІ ЯК ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ СОЛІ ЯК ЕЛЕКТРОЛІТИ При розчиненні у воді солі дисоціюють з утворенням позитивно заряджених іонів металу (або амонію NН4+) і негативно заряджених кислотних залишків. Ці іони і визначають поведінку солей у розчинах. Солі можуть взаємодіяти з кислотами: З лугами: З іншими солями: І тут, як і в усіх реакціях, які відбуваються […]...
- Слабкі кислоти й основи – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Слабкі кислоти й основи У слабких кислот і основ дисоціація є неповною. Внаслідок цього в розчині є недисоційовані молекули. Тому показник pH неможливо розрахувати лише з концентрації кислоти або основи. Додатково потрібна інформація про стан протолітичної рівноваги: Оскільки в цьому випадку концентрація молекул води […]...
- Кислоти й основи, за Льюїсом – Визначення кислот і основ КИСЛОТИ Й ОСНОВИ 1. Визначення кислот і основ 1.3. Кислоти й основи, за Льюїсом Визначення, запропоноване Гілбертом Н. Льюїсом, не обмежується розглядом перенесення протонів. Згідно з цим визначенням, кислотами є частинки, атоми яких мають незаповнені валентні оболонки. Кислота – це частинка з незавершеною електронною конфігурацією. Основа є частинкою, яка надає пару електронів для утворення ковалентного […]...
- ВЗАЄМОДІЯ ВОДИ З ОКСИДАМИ. ПОНЯТТЯ ПРО ОСНОВИ, КИСЛОТИ, ІНДИКАТОРИ Тема 3 ВОДА & 36. ВЗАЄМОДІЯ ВОДИ З ОКСИДАМИ. ПОНЯТТЯ ПРО ОСНОВИ, КИСЛОТИ, ІНДИКАТОРИ Вивчення параграфа допоможе вам: · наводити приклади формул кислот і основ; · складати рівняння реакцій води з деякими оксидами; · розпізнавати дослідним шляхом кислоти і луги Вода вступає в хімічні реакції з багатьма речовинами. Розглянемо, як вона взаємодіє з оксидами та […]...
- Взаємодія води з оксидами. Поняття про гідрати оксидів: кислоти й основи Тема 3 Вода & 24. Взаємодія води з оксидами. Поняття про гідрати оксидів: кислоти й основи Опанувавши цю тему, ви зможете: – розрізняти основи й кислоти як гідрати оксидів; – наводити приклади гідратів оксидів, утворених оксидами неметалічних і металічних елементів; – розпізнавати кислоти й основи, розчинні у воді, за допомогою індикаторів; – складати рівняння реакцій […]...
- Кислоти – НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 6. НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК § 6.2. Кислоти Означення класу кислот з погляду теорії електролітичної дисоціації див. § 5.8. Наведені там приклади рівнянь їх дисоціації можна записати точніше, із урахуванням гідратації іонів: НСl (газ) ⇆Н+ (водн.) + Сl (водн.); СН3СООН (водн.) […]...
- Сильні й слабкі електроліти – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.10. Сильні й слабкі електроліти Розрізняють сильні й слабкі електроліти. Сильні електроліти під час розчинення у воді повністю дисоціюють на іони. До них належать: 1) майже всі солі; 2) багато мінеральних кислот, наприклад H2SO4, HNO3, […]...
- Електроліти та електролітична дисоціація – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Електроліти та електролітична дисоціація Усі речовини можна розділити на електроліти та неелектроліти. Електроліти – це речовини, розчини або розплави яких проводять електричний струм. Розчини й розплави неелектролітів електричний струм не проводять. До електролітів відносять речовини з іонною будовою, а також речовини […]...
- Основи – ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Основи Поняття про основи, їхній склад та назви Неорганічні основи ще називають гідроксидами, тому що вони складаються з двох частин: атомів металічних елементів та гідроксигруп Е(ОН)х. Наприклад, NaOH, Са(ОН)2, Аl(OН)3. Основи – це складні речовини, які складаються з атома […]...
- Основи, їх склад і назви. Класифікація основ Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 15 Тема. Основи, їх склад і назви. Класифікація основ Цілі уроку: розширити знання про класифікацію й номенклатуру неорганічних речовин на прикладі основ; розвивати вміння й навички складати формули неорганічних сполук за валентністю на прикладі основ, складати назви речовин за сучасною українською номенклатурою, розпізнавати класи неорганічних речовин. Тип уроку: […]...
- Тема 15. Основи – ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Тема 15. Основи Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Позначте іони, що обумовлюють перетворення забарвлення фенолфталеїну на рожеве: A. Гідроксид-іони; Б. Іони Гідрогену; B. Сульфат-іони; Г. Йони Кальцію. 2. Позначте речовину, що реагує з […]...
- РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ У розчинах електролітів у хімічну взаємодію вступають іони. З’ясуємо, у яких випадках це відбувається. Якщо змішати водні розчини кухонної солі (хлориду натрію) і вапняної води (розчину гідроксиду кальцію), то зовнішніх змін не спостерігається. Формально можна написати З огляду на те, що всі чотири речовини (хлорид і […]...
- Поняття про амфотерні основи Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 24 Тема. Поняття про амфотерні основи Цілі уроку: розглянути поняття амфотерності як здатності сполук проявляти двоїсті властивості: і кислот, і основ; розширити знання учнів про властивості основ і кислот на прикладі амфотерних сполук; формувати вміння й навички складання рівнянь хімічних реакцій на прикладі амфотерних основ. Тип уроку: поглиблення […]...
- Ступінь дисоціації. Сильні та слабкі електроліти Тема 1 РОЗЧИНИ Урок 13 Тема уроку. Ступінь дисоціації. Сильні та слабкі електроліти Цілі уроку: розширити знання учнів про електроліти; ознайомити з поняттями “сильні та слабкі електроліти”; показати кількісну характеристику процесу електролітичної дисоціації – ступінь дисоціації; закріпити навички складання рівнянь дисоціації кислот, основ і солей; визначити відмінності сильних і слабких електролітів. Тип уроку: комбінований урок […]...
- Тема 40. Карбонові кислоти Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ОРГАНІЧНА ХІМІЯ Тема 40. Карбонові кислоти Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Укажіть речовину, за допомогою якої можна визначити оцтову кислоту у розчині: A. Калій гідроксид; Б. Аргентум оксид; B. Лакмус; Г. Фенолфталеїн. 2. Укажіть речовину, яка необхідна […]...
- ГІДРОЛІЗ СОЛЕЙ – ВУГЛЕЦЬ І ЙОГО СПОЛУКИ Хімія – універсальний довідник ВУГЛЕЦЬ І ЙОГО СПОЛУКИ ГІДРОЛІЗ СОЛЕЙ У нейтральних розчинах, тобто за відсутності кислот і лугів, у результаті дисоціації (дуже слабкої) води утворюються однакові кількості іонів Н+ і ОН-: Додавання до води кислоти збільшує концентрацію іонів Н+ і, зміщуючи рівновагу дисоціації води вліво, знижує концентрацію іонів ОН-. Отже, кислий розчин містить більше […]...
- Кислоти – ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Кислоти Поняття про кислоти, їхній склад та назви Кислоти – це складні речовини, які складаються з атомів Гідрогену, що можуть заміщатися атомами металічних елементів, та кислотних залишків. Згідно із теорією кислот та основ Арреніуса, кислотам можна дати інше визначення, […]...
- Сильні та слабкі електроліти – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Сильні та слабкі електроліти Усі електроліти поділяють на сильні та слабкі. Сильні електроліти в розчинах дисоціюють повністю, а слабкі – частково, тобто частина молекул залишається в недисоційованому стані. До сильних електролітів відносять усі солі (за незначним винятком), луги (гідроксиди лужних металів, […]...
- Насичені монокарбонові кислоти – Карбонові кислоти – Оксигеновмісні органічні сполуки ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ III. ОРГАНІЧНА ХІМІЯ 12. Оксигеновмісні органічні сполуки 12.4. Карбонові кислоти Карбонові кислоти – це похідні вуглеводнів, до складу молекул яких входять одна або декілька карбоксильних груп – СООН. Класифікація карбонових кислот Розрізняють: 1) залежно від кількості карбоксильних груп (основності): – монокарбонові (однооснбвні): НСООН мурашина (метанова) кислота […]...
- Електролітична дисоціація. Електроліти й неелектроліти Тема 1 РОЗЧИНИ Урок 11 Тема уроку. Електролітична дисоціація. Електроліти й неелектроліти Цілі уроку: формувати уявлення учнів про процеси, що відбуваються в розчинах; ознайомити з поняттям “електролітична дисоціація”; пояснити залежність електролітичної дисоціації від будови молекул розчиненої речовини й розчинника; ознайомити учнів з поділом речовин на електроліти й неелектроліти за електропровідністю в розчині або розплаві. Тип […]...
- Карбонові кислоти. Насичені карбонові кислоти. Фізичні властивості. Номенклатура II Семестр Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 37 Тема уроку. Карбонові кислоти. Насичені карбонові кислоти. Фізичні властивості. Номенклатура Цілі уроку: розвивати знання учнів про карбонільні органічні сполуки на прикладі карбонових кислот; формувати знання про карбоксильну функціональну групу на прикладі карбонових кислот; ознайомити учнів зі структурною й електронною формулами оцтової кислоти; показати зв’язок між функціональною […]...
- Поняття про вищі карбонові кислоти Тема 3 НАЙВАЖЛИВІШІ ОРГАНІЧНІ СПОЛУКИ Урок 49 Тема уроку. Поняття про вищі карбонові кислоти Цілі уроку: формувати знання учнів про вищі насичені й ненасичені карбонові кислоти; ознайомити з окремими представниками цього класу, практичним значенням реакції вищих карбонових кислот з утворенням солей – основного компонента мила; показати практичне значення й застосування вищих карбонових кислот. Тип уроку: […]...
- Гідроліз солей як окремий випадок реакцій йонного обміну у водних розчинах електролітів ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.11. Гідроліз солей як окремий випадок реакцій йонного обміну у водних розчинах електролітів У хімії часто стикаються з явищем гідролізу1 – хімічної взаємодії речовин з водою. Найбільше практичне значення має гідроліз солей. Гідроліз солей – це хімічна взаємодія солей […]...
- Генетичні зв’язки між класами неорганічних речовин – Основні класи неорганічних сполук ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 7. Основні класи неорганічних сполук 7.6. Генетичні зв’язки між класами неорганічних речовин Між класами речовин – простими (металами і неметалами) і складними (оксидами, кислотами, основами, солями) – існує зв’язок і можливість взаємного переходу: Зв’язки між класами неорганічних речовин, які грунтуються на одержанні речовин […]...
- Солі ортофосфатної кислоти – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.12. Солі ортофосфатної кислоти Як трьохосновна кислота Н3РO4 утворює три ряди солей: 1) середні (нормальні): К3РО4 – калій ортофосфат, Mg3(PO4)2-магній ортофосфат; І кислі: 2) однозаміщені: КН2РO4 – калій дигідрогенфосфат, Са(Н2РO4)2 – кальцій […]...
- Нейтралізація слабких кислот і основ – Нейтралізація КИСЛОТИ Й ОСНОВИ 3. Нейтралізація При змішуванні рівних об’ємів соляної кислоти і розчину їдкого натру однакових концентрацій, утворюється нейтральний розчин натрій хлориду, що має показник pH = 7. Таким чином, кислотні і лужні властивості початкових речовин нейтралізуються. Нейтралізація є реакцією взаємодії іонів гідроксонію і гідроксид-іонів з утворенням молекул води: Н3О+ + ОН – 2 Н2О. […]...
- Солі карбонатної кислоти – ПІДГРУПА КАРБОНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 11. ПІДГРУПА КАРБОНУ § 11.4. Солі карбонатної кислоти Карбонатна кислота утворює два ряди солей: середні – карбонати і кислі – гідрокарбонати. Вони виявляють загальні властивості солей. Карбонати і гідрокарбонати лужних металів та амонію добре розчиняються у воді. Солі карбонатної кислоти – […]...
- Взаємодія нітратної кислоти з металами і неметалами – ПІДГРУПА НІТРОГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 10. ПІДГРУПА НІТРОГЕНУ § 10.8. Взаємодія нітратної кислоти з металами і неметалами При взаємодії нітратної кислоти з металами водень, як правило, не виділяється: він окиснюється, утворюючи воду. Кислота ж, залежно від концентрації і активності металу, може відновлюватися до сполук: +5 +4 […]...
- Оксиди фосфору і фосфатні кислоти – ПІДГРУПА НІТРОГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 10. ПІДГРУПА НІТРОГЕНУ § 10.11. Оксиди фосфору і фосфатні кислоти Оксиди фосфору. Фосфор утворює декілька оксидів. Найважливішими з них є Р4О6 та Р4О10. Часто їх формули пишуть у спрощеному вигляді як Р2О3 та Р2О5 (індекси попередніх поділено на 2). Оксид фосфору(ІІІ) […]...
- Їдкі луги – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.3. Їдкі луги Їдкими лугами називаються добре розчинні у воді гідроксиди. Найважливіші з них NaOH та КОН. Гідроксид натрію і гідроксид калію – білі, непрозорі, тверді кристалічні речовини. У воді добре розчиняються з виділенням великої кількості […]...