Контроль рівня навчальних досягнень з тем “Вуглеводні” та “Природні джерела вуглеводнів та їх переробка”
І СЕМЕСТР
Тема 3. ПРИРОДНІ ДЖЕРЕЛА ВУГЛЕВОДНІВ ТА ЇХ ПЕРЕРОБКА
Урок 28
Тема уроку. Контроль рівня навчальних досягнень з тем “Вуглеводні” та “Природні джерела вуглеводнів та їх переробка”
Цілі уроку: узагальнити й скоригувати знання учнів з тем “Вуглеводні” та “Природні джерела вуглеводнів та їх переробка”; визначити рівень навчальних досягнень учнів з тем, розуміння головних понять, уміння використовувати їх на практиці.
Тип уроку: контролю й коригування знань, умінь і навичок.
Форми роботи: письмова
Обладнання: картки-завдання.
ХІД УРОКУ
I. Організація класу
II. Письмова контрольна робота
Учитель коментує зміст завдань, розподіляє варіанти, повідомляє час виконання, ключові моменти оформлення відповідей і систему оцінювання:
– завдання 1, 2, 3, 4, 5, 6 – тестові, кожне завдання оцінюється в 0,5 бала, у сумі перші шість завдань – 3 бали;
– завдання 7, 8, 9 оцінюються по 2 бали, разом за дев’ять правильно виконаних завдань – 9 балів;
– завдання 10 пропонується учням, які претендують на оцінку 12 балів, оцінюється в 3 бали.
Отже, максимальна оцінка
Час на виконання роботи – 40 хв.
III. Домашнє завдання
Повторити матеріал про природні джерела вуглеводнів.
Варіант І
1. У результаті повного гідрування алкінів утворюються:
А) циклоалкани;
Б) алкани;
В) альдегіди;
Г) вуглеводи.
2. До природних джерел вуглеводнів не належать:
А) нафта;
Б) вапняки;
В) природний газ;
Г) кам’яне вугілля.
3. Назвіть вид ізомерії, не характерний для алкінів:
А) структурна;
Б) положення кратного зв’язку;
В) просторова;
Г) міжкласова.
4. Для аренів характерними є реакції:
А) приєднання й заміщення;
Б) приєднання й обміну;
В) заміщення й обміну.
5. Об’єм хлору, що приєднується до 7 л пропену, дорівнює:
А) 14 л;
Б) 10 л;
В) 7 л;
Г) 22,4 л.
6. Молекулярна формула вуглеводню, масова частка Гідрогену в якому становить 17,2 %, а відносна густина за азотом – 2,07:
А) C2H4;
Б) C4H8;
В) C3H8;
Г) C4H10.
7. Складіть структурні формули ізомерів диметилбензену й назвіть їх.
8. Напишіть рівняння реакцій, необхідні для здійснення перетворень:
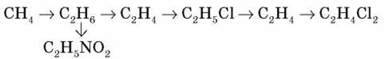
9. 0,672 л (за н. у.) деякого вуглеводню спалили. При цьому утворилися вуглекислий газ масою 3,96 г і вода масою 2,16 г. Відносна густина цього вуглеводню за киснем дорівнює 1,375. Визначте молекулярну формулу цієї речовини. (C3H8)
10. Обчисліть, яку масу нітробензену можна одержати в результаті взаємодії 25 г бензену й 25 г нітратної кислоти, якщо вихід нітробензену становить 75 % від теоретично можливого.
Варіант ІІ
1. У лабораторії бромну воду використовують:
А) для одержання вуглеводнів;
Б) визначення ненасичених вуглеводнів;
В) інших цілей.
2. До процесів переробки нафти належать:
А) крекінг;
Б) ізомеризація;
В) горіння;
Г) полімеризація.
3. Назвіть вид ізомерії, характерний виключно для алкенів:
А) структурна;
Б) положення кратного зв’язку;
В) просторова;
Г) міжкласова.
4. Найпростіший представник класу аренів:
А) гексен;
Б) бензен;
В) гексан;
Г) гексин.
5. Об’єм водню, необхідний для повного гідрування 15 л бутину, дорівнює:
А) 15 л;
Б) 30 л;
В) 7,5 л;
Г) 3,5 л.
6. Молекулярна формула вуглеводню, масова частка Карбону в якому становить 90 %, а відносна густина за гелієм дорівнює 30:
А) C9H9;
Б) C9H12;
В) C4H10;
Г) C2H4.
7. Складіть структурні формули чотирьох ізомерів, що відповідають формулі C8H10, і назвіть їх.
8. Напишіть рівняння реакцій, необхідні для здійснення перетворень:
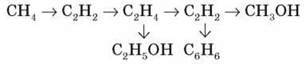
9. Унаслідок згоряння 0,224 л деякого вуглеводню (за н. у.) утворилися вуглекислий газ об’ємом 0,448 л і вода масою 0,18 г. Відносна густина речовини за гелієм дорівнює 6,5. Визначте молекулярну формулу цієї речовини. (2H2)
10. Обчисліть, який об’єм ацетилену (н. у.) можна одержати з 250 г кальцій карбіду, що містить 25 % домішок, якщо вихід ацетилену становить 80 % від теоретично можливого.
Варіант ІІІ
1. До гомологічного ряду алкенів належить:
А) C2H2;
Б) C6H6;
В) C2H6;
Г) C6H12.
2. Природний газ не використовується:
А) в органічному синтезі;
Б) як паливо;
В) для зварювання металів.
3. Назвіть вид ізомерії, характерний для алканів:
А) структурна;
Б) положення кратного зв’язку;
В) просторова;
Г) міжкласова.
4. Просторова будова молекули бензену:
А) лінійна;
Б) тетраедрична;
В) плоска.
5. Об’єм водню, що виділиться в результаті термічного розкладання 12 л метану:
А) 22,4 л;
Б) 6 л;
В) 12 л;
Г) 24 л.
6. Молекулярна формула вуглеводню, масова частка Карбону в якому становить 85,68 %, а відносна густина за вуглекислим газом – 1,27:
А) C4H10;
Б) C4H8;
В) C6H6;
Г) C3H4.
7. Складіть структурні формули чотирьох ізомерів речовини складу C9H12 і назвіть їх.
8. Напишіть рівняння реакцій, необхідних для здійснення перетворень:
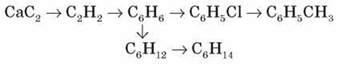
9. 0,72 г вуглеводню спалили. При цьому виділилися 1,12 л вуглекислого газу (за н. у.) і вода масою 1,08 г. Відносна густина парів цієї речовини за киснем – 2,25. Визначте формулу цієї сполуки. (C5H12)
10. Обчисліть, який об’єм етану (н. у.) можна одержати в результаті взаємодії 14 л ацетилену й 20 л водню, якщо вихід етану становить 75 % від теоретично можливого.
