Лужні метали. Натрій і Калій
РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ ІА – ІІІА ГРУП
§ 58. Лужні метали. Натрій і Калій
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати фізичні та хімічні властивості, способи добування натрію і калію в промисловості;
Складати рівняння реакцій, схеми електронного балансу відповідних хімічних реакцій;
Обгрунтовувати застосування натрію та калію їх властивостями.
Фізичні властивості лужних металів зумовлені особливостями їх будови. Як усі метали вони мають металічну кристалічну
Для цих металів характерні металічний блиск (мал. 102), пластичність, висока електро – та теплопровідність, а також незначні густина (легші за воду і не тонуть у ній) і твердість, низькі температури плавлення (більшість з них плавиться в гарячій воді) і досить високі температури кипіння.
Зі збільшенням атомного номера лужних елементів зростає густина їх простих речовин (йони в кристалічних


Мал. 102. Лужні метали: а – літій; б – натрій; в – калій; г – рубідій; г – цезій

Мал. 103. Різання натрію ножем
Добування. У природі лужні метали у вільному стані не трапляються, а існують у складі солей. Відновити їх із цих сполук іншими металами неможливо, бо лужні метали найактивніші серед них. Однак це можна зробити за допомоги електричного струму.
У промисловості натрій добувають електролізом розплаву його солей, наприклад натрій хлориду:
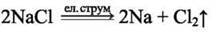
Для добування калію в промисловості замість електролізу застосовують реакцію заміщення між натрієм і розплавом калій хлориду як більш безпечну:
Na + m = NaCl + К Хімічні властивості розглянемо на прикладі найважливіших з лужних металів – натрію і калію.
Взаємодія з неметалами. Як типові метали і сильні відновники натрій і калій взаємодіють майже з усіма неметалами, включаючи водень, а також із водою, кислотами, оксидами металічних елементів, деякими органічними сполуками. Усі ці реакції є окисно-відновними. Натрій і калій у них віддають один електрон, набуваючи позитивного заряду:
Е – 1е -›Е+
За нагрівання натрій і калій реагують з воднем з утворенням гідридів:
2Na + H2 = 2NaH
Гідриди – це тверді речовини з йонними кристалічними гратками, легко розкладаються водою з виділенням водню:
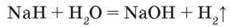
Натрій і калій горять у кисні (мал. 104, а). Під час реакції утворюють не оксиди, а натрій – пероксид NaO2 йонної будови з аніоном О2-, калій – надпероксид КО2 (К2О4) з аніоном О2:

Як домішки утворюються оксиди Na2O і К2О. Оскільки лужні метали окиснюються на повітрі, їх зберігають під шаром гасу, з яким вони не взаємодіють (мал. 104, б).
З азотом під час нагрівання ці метали утворюють нітриди, з галогенами – галогеніди, сіркою – сульфіди (мал. 104, в).
– Складіть рівняння реакцій натрію із зазначеними неметалами.
Взаємодія з водою відбувається бурхливо, з калієм енергійніше за натрій. Водень, що виділяється, самозаймається.
– Складіть рівняння реакцій. Поміркуйте, чому калій більш активний, ніж натрій.

Мал. 104. Реакція натрію з киснем (а), зберігання натрію під шаром гасу (б), горіння натрію в сірці (в)
Взаємодія з кислотами. Натрій і калій здатні витискувати водень не лише з води, а й із розбавлених кислот – слабких окисників (НСІ, CH3COOH, H2SO4, H2S, HBr):
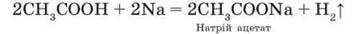
Реакції лужних металів з кислотами – сильними окисниками перебігають бурхливо, іноді з вибухом:
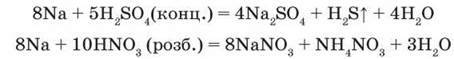
Взаємодія з оксидами металічних елементів. Натрій як сильний відновник витісняє деякі металічні елементи з їх оксидів за високих температур, наприклад:
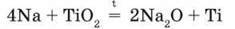
Взаємодія з органічними сполуками. Під час вивчення органічної хімії в 9 класі ви дізналися про участь натрію в реакціях з деякими органічними сполуками, наприклад спиртами, з яких натрій витісняє водень:
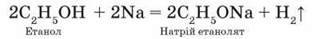
Складанням схем електронного балансу розглянутих реакцій доведіть відновні властивості лужних металів.
Застосування лужних металів зумовлене їх фізико-хімічними властивостями. Так, натрій легко взаємодіє з киснем повітря, тому його використовують для видалення бульбашок газу зі сплавів металів. У складі сплавів він надає їм здатності стискуватися і при цьому не розтріскуватися, зберігати твердість. З них виробляють осьові підшипники для залізничного транспорту, оскільки вони працюють в умовах постійної та різкої зміни навантажень. Натрій, іноді разом з калієм, застосовується в кольоровій металургії як відновник для добування важких металів; у ядерних реакторах – як теплоносій; при добуванні синтетичного каучуку – як каталізатор; є осушувачем органічних речовин.
Високу хімічну активність літію використовують для виготовлення радіоламп. Для створення вакууму в колбу вносять невеличкий шматочок літію, який миттєво поглинає залишки повітря.
Властивість рубідію та цезію реагувати на світло застосовується у фотоелементах: при освітленні їх поверхні вони стають джерелом електричного струму, при зникненні освітлення струм так само зникає. Фотоелементи широко використовуються в звуковому кіно, на телебаченні. Найкращі фотоелементи виробляють зі сплаву стибію та цезію.
Існують проекти використання францію для ранньої діагностики раку: встановлено, що він накопичується в ракових пухлинах.
Коротко про головне
Натрій і калій є хімічно активними металами, взаємодіють майже з усіма неметалами, а також із водою, кислотами, оксидами металічних елементів, органічними сполуками. В усіх реакціях вони – тільки відновники. Під час горіння на повітрі натрій утворює пероксид, а калій – надпероксид, речовини йонної будови.
У промисловості натрій добувають електролізом розплаву його солей або лугу, а калій – реакцією заміщення між натрієм і сіллю Калію.
Натрій використовують у металургії, атомній енергетиці, органічному синтезі, а Калій – зазвичай у вигляді його сполук.
