МОЛЯРНИЙ ОБ’ЄМ ГАЗУ – ГАЗОПОДІБНИЙ СТАН РЕЧОВИНИ
Хімія – універсальний довідник
ГАЗОПОДІБНИЙ СТАН РЕЧОВИНИ
МОЛЯРНИЙ ОБ’ЄМ ГАЗУ
Найважливішим для хімії наслідком із закону Авогадро є уявлення про молярний об’єм газів.
Згадаємо, що таке моль для речовин, які складаються з молекул. Моль – кількість речовини, що містить число молекул, рівне числу Авогадро NA (6,02 – 1023). Отже, на підставі закону Авогадро дійдемо висновку, що будь-які гази в кількості, рівній 1 моль, за однакових умов повинні займати однаковий об’єм, який не залежить від природи газоподібної речовини,
При температурі 0 °С і тиску, рівному 1 атм (101,325 кПа) (ці умови зазвичай називають нормальними і позначають н. у.), об’єм 1 моль газу, тобто молярний об’єм, дорівнює 22,4 л (Vм = 22,4 л/моль). Зазвичай, мають на увазі саме ці умови і цей молярний об’єм (якщо немає спеціальних застережень).
Закон Авогадро має ще один важливий наслідок. Коефіцієнти в рівнянні хімічної реакції вказують, у яких відносних кількостях речовини (реагенти і продукти реакції) вступають у взаємодію. А оскільки об’єми газоподібних речовин пропорційні
Зв’язок об’ємів газів, що реагують, із коефіцієнтами рівняння реакції дозволяє проводити чимало розрахунків без обчислення маси газоподібної речовини, що дуже зручно, тому що на практиці, зазвичай, вимірюють об’єм газу, а не його масу.
Розв’яжемо наступну задачу. Потрібно розрахувати, скільки грамів води необхідно розкласти електричним струмом, щоб одержати 1 л кисню, і який об’єм матиме водень, що виділився при цьому.
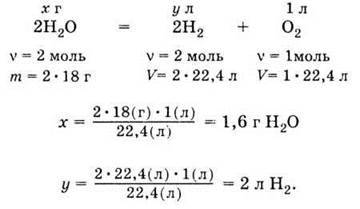
Розрахунок об’єму водню в цьому прикладі взагалі усне завдання при наступному записі:
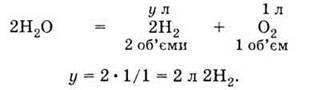
Якщо відомі молярна маса М і молярний об’єм речовини Vм, то його густину можна визначити за відношенням ρ = М/VM. Для газів Vм = 22,4 л/моль – константа, отже, їхня густина пропорційна молярній масі.
Запам’ятавши, що середня відносна молекулярна маса повітря дорівнює 29, можна легко порівнювати густину будь-якого газу з густиною повітря без знання їхніх густин.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- ЗАКОН АВОГАДРО – ГАЗОПОДІБНИЙ СТАН РЕЧОВИНИ Хімія – універсальний довідник ГАЗОПОДІБНИЙ СТАН РЕЧОВИНИ ЗАКОН АВОГАДРО Об’єм деякої порції газу залежить від кількості молекул у ній (тобто, від кількості речовини), зовнішнього тиску і температури і не залежить від природи газу. Звідси випливає висновок, зроблений на початку минулого століття А. Авогадро, що дістав назву закону Авогадро: В однакових об’ємах різних газів за однакових […]...
- Молярний об’єм газів. Обчислення об’єму газу за нормальних умов Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 7 Тема. Молярний об’єм газів. Обчислення об’єму газу за нормальних умов Цілі уроку: ознайомити учнів з поняттям “молярний об’єм”; розкрити особливості використання поняття “молярний об’єм” для газоподібних речовин; навчити учнів використовувати отримані знання для розрахунків об’ємів газів за нормальних умов. Тип уроку: комбінований. Форми роботи: розповідь […]...
- Закон Авогадро. Молярний об’єм газу. Об’ємні співвідношення газів у реакціях ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина 1.8. Закон Авогадро. Молярний об’єм газу. Об’ємні співвідношення газів у реакціях Італійський учений А. Авогадро звернув увагу на те, що всі гази однаково стискуються (закон Бойля – Маріотта1), мають однаковий термічний коефіцієнт розширення (закон Гей-Люссака2) та деякі інші […]...
- Газові закони. Закон Авогадро. Молярний об’єм газу ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ § 1.11. Газові закони. Закон Авогадро. Молярний об’єм газу Оскільки гази є найпростішим об’єктом для дослідження, то їх властивості й реакції між газуватими речовинами вивчено найповніше. Французький учений Ж. Л. Гей-Люссак встановив закон об’ємних відношень: […]...
- ГАЗИ – ГАЗОПОДІБНИЙ СТАН РЕЧОВИНИ Хімія – універсальний довідник ГАЗОПОДІБНИЙ СТАН РЕЧОВИНИ ГАЗИ Газоподібний стан речовини принципово відрізняється від конденсованого, тобто рідкого або твердого. У конденсованому стані молекули (або інші частинки), що утворюють речовину, знаходяться в безпосередньому зіткненні одна з одною. При цьому вони сильно взаємодіють між собою, і характер цієї взаємодії визначає чимало властивостей речовини. У газі молекули не […]...
- ДЕЯКІ ФІЗИЧНІ ВЕЛИЧИНИ І ЇХ ОДИНИЦІ – ЗАКОНИ ЗБЕРЕЖЕННЯ. СТЕХІОМЕТРІЯ Хімія – універсальний довідник ЗАКОНИ ЗБЕРЕЖЕННЯ. СТЕХІОМЕТРІЯ У хімічних реакціях атоми не утворюються заново і не руйнуються. Цей факт відображають закони стехіометрії. Маса речовин, які вступили в хімічну реакцію, дорівнює масі речовин, які утворилися в результаті реакції (закон збереження маси). Об’єми газів, що реагують, відносяться один до одного і до об’єму отриманих газів як прості […]...
- ОДИНИЦЯ КІЛЬКОСТІ РЕЧОВИНИ – МОЛЬ Хімія – універсальний довідник КІЛЬКІСНІ ВІДНОШЕННЯ В ХІМІЇ ОДИНИЦЯ КІЛЬКОСТІ РЕЧОВИНИ – МОЛЬ Речовини, що вступають в хімічну взаємодію, можуть складатися з атомів, або молекул, або інших частинок. Кількість речовини, що реагує, зручно характеризувати числом таких частинок. Одиницею кількості речовини, що визначає число частинок, з яких ця речовина складається, є моль. Кількість речовини, виражена в […]...
- МОЛЯРНА МАСА. КІЛЬКІСТЬ РЕЧОВИНИ Фізика підготовка до ЗНО комплексне видання МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА 1. ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ 1.4. МОЛЯРНА МАСА. КІЛЬКІСТЬ РЕЧОВИНИ Один моль – кількість речовини, у якій міститься стільки ж молекул або атомів, скільки в Карбоні 126С масою 0,012 кг. Стала Авогадро (NА) – число атомів або молекул в 1 молі будь-якої речовини: Згідно із законом […]...
- Умовні позначення, назви та одиниці фізичних величин ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ ДОДАТОК 1. Умовні позначення, назви та одиниці фізичних величин η – Вихід продукту (масова частка виходу) – Аr – Відносна атомна маса – Mr – Відносна молекулярна маса – DH2 – Відносна густина за воднем – Dn – Відносна густина за повітрям – Х – Відносна […]...
- Об’ємні відношення газів у хімічних реакціях. Закон Авогадро Хімія Загальна хімія Основні поняття, закони й теорії хімії Об’ємні відношення газів у хімічних реакціях. Закон Авогадро Закон об’ємних відношень Гей-Люссака Гази реагують між собою у певних об’ємних відношеннях. У 1808 р. Ж. Л. Гей-Люссак установив таку закономірність: Об’єми газів, що вступають у реакцію, відносяться один до одного і до газоподібних продуктів реакції як невеликі […]...
- Кількість речовини. Стала Авогадро. Молярна маса Хімія Загальна хімія Основні поняття, закони й теорії хімії Кількість речовини. Стала Авогадро. Молярна маса Кількість речовини (n) – це визначене число будь-яких структурних одиниць (атомів, молекул, іонів тощо). Одиниця виміру кількості речовини – Моль. В 1 моль число будь-яких частинок дорівнює , тобто стільки ж, скільки міститься в 0,012 кг вуглецю. Це число визначене […]...
- Тематичне оцінювання з теми “Кількість речовини. Розрахунки за хімічними формулами” Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 10 Тема. Тематичне оцінювання з теми “Кількість речовини. Розрахунки за хімічними формулами” Цілі уроку: перевірити рівень знань учнів та їх уміння виконувати розрахунки з використанням понять “кількість речовини”, “молярна маса”, “молярний об’єм”, “відносна густина газу”; виявити рівень навчальних досягнень учнів з теми. Тип уроку: контроль знань, […]...
- ЕНЕРГІЯ ГІББСА. УТВОРЕННЯ РЕЧОВИНИ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ЕНЕРГІЯ ГІББСА. УТВОРЕННЯ РЕЧОВИНИ Стандартною молярною енергією Гіббса утворення речовини ΔG°УТB<298 називають зміну енергії Гіббса при утворенні 1 моль речовини з простих речовин у стандартних умовах. Стандартна молярна енергія Гіббса утворення простої речовини, стійкої у стандартних умовах, дорівнює нулю. Одиниця виміру енергії Гіббса утворення речовини – […]...
- Обчислення кількості атомів (молекул) у певній кількості речовини Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 4 Тема. Обчислення кількості атомів (молекул) у певній кількості речовини Цілі уроку: формувати вміння і практичні навички хімічних обчислень з використанням понять “кількість речовини”, “моль”, “стала Авогадро”. Тип уроку: формування вмінь і навичок. Форми роботи: керована практика, самостійна робота. Обладнання: Періодична система хімічних елементів Д. І. […]...
- Розрахунки за формулами для обчислення кількості речовини – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач І. Розрахунки за формулами для обчислення кількості речовини Формули і поняття, які використовуються: Де n(Х) – кількість речовини X, моль, M(Х) – маса речовини X, г, V(X) – об’єм газу X за нормальних умов, […]...
- Визначення констант рівноваги – Характеристики хімічної рівноваги ХІМІЧНА РІВНОВАГА 1. Характеристики хімічної рівноваги 1.3. Визначення констант рівноваги Знаючи концентрації речовин, що знаходяться в стані рівноваги, можна обчислити відповідну константу рівноваги. Приклад. Початкова кількість речовини n0 = 1 моль гідроген йодиду в реакції з утворенням водню і йоду при температурі Т = 446 °С розпалася n = 0,22 моль (н. у.). Відповідно до […]...
- Довідник формул Хімія Загальна хімія Основні поняття, закони й теорії хімії Довідник формул ; ; Об’єм V (л) ; ; Кількість речовини n (моль) ; ; Молярна маса M (г/моль) ; ; Число частинок N ; ; Густина (г/мл) Відносна густина D Масова частка елемента в складній речовині Масова частка (%) Маса розчину ; Вихід продукту реакції […]...
- Кількість речовини. Моль Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 3 Тема. Кількість речовини. Моль – одиниця кількості речовини. Стала Авогадро Цілі уроку: сформувати уявлення учнів про хімічне поняття “кількість речовини”; показати сутність фізичної величини кількості речовини; ознайомити з одиницею вимірювання кількості речовини; увести поняття “моль”, “стала Авогадро”. Тип уроку: вивчення нового матеріалу. Форми роботи: розповідь […]...
- Розв’язування задач на рівняння стану ідеального газу ВЛАСТИВОСТІ ГАЗІВ, РІДИН, ТВЕРДИХ ТІЛ* Урок № 7 Тема. Розв’язування задач на рівняння стану ідеального газу Мета: сприяти глибокому розумінню величин, що характеризують стан термодинамічної системи, уміння використовувати отримані знання під час пояснення фізичних явищ, розвивати логічне мислення. ХІД УРОКУ I. Перевірка знань під час фронтального опитування 1. Що ми розуміємо під рівнянням стану газу? […]...
- Обчислення відносної густини газу – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач III. Обчислення відносної густини газу Формули і поняття, які використовуються: Де Dnов.(X) – відносна густина газу X за повітрям, DA(X) – відносна густина газу X за газом А, М(Х) – молярна маса газу X, […]...
- Кількість речовини, молярна маса ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина 1.7. Кількість речовини, молярна маса Кількість речовини п (або V, ню) – це фізична величина, яка визначає кількість частинок (молекул, атомів, йонів, йонних угруповань – асоціатів) у певній її порції. Одиницею вимірювання кількості речовини є моль. Моль – […]...
- Внутрішня енергія і теплоємність ідеального газу ФІЗИКА Частина 2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА Розділ 4 ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ ГАЗІВ 4.6. Внутрішня енергія і теплоємність ідеального газу Оскільки молекули ідеального газу на відстані не взаємодіють, внутрішня енергія такого газу складається лише з кінетичних енергій окремих молекул. Тоді внутрішня енергія моля ідеального газу дорівнюватиме добутку числа Авогадро на середню кінетичну енергію однієї молекули: […]...
- Тема 2. Закон збереження маси. Кількість речовини – ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Тема 2. Закон збереження маси. Кількість речовини Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Позначте прізвище вченого, ім’ям якого названо число частинок, що міститься в 1 моль будь-якої речовини: A. Менделєєв; Б. […]...
- ЗАКОН ГЕССА. РОЗРАХУНОК ЕНТАЛЬПІЇ ХІМІЧНОЇ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ЗАКОН ГЕССА. РОЗРАХУНОК ЕНТАЛЬПІЇ ХІМІЧНОЇ РЕАКЦІЇ Тепловий ефект реакції залежить від початкового і кінцевого станів системи і не залежить від шляху реакції (закон Гесса). Наприклад: Кількість теплоти, яка виділяється під час спалювання метану СН4, не залежить від того, протікає реакція за одну стадію чи за дві […]...
- Тема 3. Газові закони. Закон Авогадро – ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Тема 3. Газові закони. Закон Авогадро Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Позначте формулювання закону Авогадро: A. Об’єми газуватих речовин в хімічній реакції пропорційні їхнім масам; Б. В однакових об’ємах різних […]...
- Урок 4. Рух молекул. Дифузія. Твердий, рідкий, газоподібний стан речовин Урок 4. Рух молекул. Дифузія. Твердий, рідкий, газоподібний стан речовин Мета: розширити уявлення про будову фізичних тіл та властивості речовин, ознайомити з поняттям “дифузія”; формувати вміння визначати агрегатний стан речовин, розвивати навички самостійної практичної роботи; виховувати цікавість до дослідницької роботи Обладнання: кульки з пластиліну, зразки речовин (ацетон, бензин, цукор, алюмінієвий дріт, олія, поліетилен, шматок міді, […]...
- КРИСТАЛІЧНИЙ СТАН РЕЧОВИНИ – КРИСТАЛИ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ КРИСТАЛИ КРИСТАЛІЧНИЙ СТАН РЕЧОВИНИ Кристали – тверді тіла, в яких атоми, іони або молекули утворюють впорядковану періодичну структуру. Кристалічні гратки – просторове періодичне розташування атомів, молекул або іонів у кристалі. Кристалічний стан характеризується дальнім порядком розташування частинок, що утворюють речовину. Рідина характеризується ближнім порядком, а газовий стан характеризується повного […]...
- Фізичні сталі – Величини та одиниці ДОДАТОК 1. Величини та одиниці Фізичні сталі Число, стала величина Символ Значення і розмірність Стала Авогадро Число Лошмідта NA(NL) 6,0221367 ∙ 1023 моль-1 Елементарний (електричний) заряд E 1,60217733 ∙ 10-19 Кл Стала Фарадея F 96487,0 Кл ∙ моль-1 Стала Планка H 6,6256 ∙ 10-34 Дж ∙ с Співвідношення мас протона й електрона M(p+)/m(e-) 1836,1527 Молярний […]...
- ЕНТРОПІЯ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ЕНТРОПІЯ Ентропію можна охарактеризувати, як ступінь безладдя (невпорядкованості) системи. Ентропію речовини прийнято відносити до стандартних умов: до тиску р = 101 325 Па (1 атм) і, зазвичай, до температури 298 К (25 °С). Ентропія 1 моль речовини у стандартному стані називається стандартною молярною ентропією. Її позначають […]...
- Розв’язування розрахункових задач на виведення формули органічної речовини Хімія Органічна хімія Вуглеводні Розв’язування розрахункових задач на виведення формули органічної речовини Задача. Визначте істинну формулу вуглеводню, при спалюванні 4,4 г якого одержали 13,2 г карбон(IV) оксиду і 7,2 г води. Відносна густина парів вуглеводню за воднем дорівнює 22. Розв’язання I спосіб 1) Напишемо рівняння реакції: . 2) Із рівняння реакції видно, що всі атоми […]...
- Рівняння стану ідеального газу 2-й семестр МОЛЕКУЛЯРНА ФІЗИКА Й ТЕРМОДИНАМІКА 1. Властивості газів, рідин, твердих тіл Урок 8/79 Тема. Рівняння стану ідеального газу Мета уроку: одержати залежність між макроскопічними параметрами (р, V, Т), що характеризують стан газу Тип уроку: вивчення нового матеріалу План уроку Контроль знань 4 хв. 1. Основне рівняння молекулярно-кінетичної теорії ідеального газу. 2. Зв’язок тиску з […]...
- Основні фізичні величини, які використовують у хімії Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ ЗАКОНИ Й ПОНЯТТЯ ХІМІЇ Основні фізичні величини, які використовують у хімії У хімії використовують такі фізичні величини: маса, об’єм, кількість речовини, густина, атомна маса, відносна атомна й молекулярна маса, молярна маса, молярний об’єм, відносна густина газів, тиск, температура, час, концентрація, швидкість хімічної […]...
- Основні фізико-хімічні величини – ХІМІЯ Формули й таблиці ХІМІЯ Основні фізико-хімічні величини № Назва Позначення Формула Одиниці вимірювання 1 Маса M – Кг(г) 2 Атомна одиниця маси А. о. м. 3 Відносна атомна маса Аr – 4 Відносна молекулярна маса Мr Де і – число атомів у молекулі – 5 Молярна маса М 6 Кількість речовини ν Моль 7 Стала […]...
- Маса і розміри молекул. Кількість речовини ВЛАСТИВОСТІ ГАЗІВ, РІДИН, ТВЕРДИХ ТІЛ* Урок № 4 Тема. Маса і розміри молекул. Кількість речовини Мета: конкретизувати положення про масу молекул, відносну молекулярну масу, кількість речовин, молярну масу, число Авогадро. Обладнання: періодична система елементів Менделєєва. План уроку 1. Визначення маси молекул та її розмірів. 2. Для чого ввели відносну атомну масу речовин. 3. Поняття кількості […]...
- Тиск газу – Гідростатика та аеростатика 5. Механіка 5.5. Гідро – та аеростатика 5.5.2. Тиск газу Тиск газу при постійній температурі залежить від його густини. Із збільшенням температури тиск газу збільшується. Із збільшенням об’єму газу його тиск зменшується, а із зменшенням об’єму – збільшується....
- Ідеальний газ. Закони ідеального газу ФІЗИКА Частина 2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА Розділ 4 ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ ГАЗІВ 4.4. Ідеальний газ. Закони ідеального газу При вивченні зміни стану важливо встановити зв’язок між різними величинами, що характеризують властивості речовини і називаються параметрами стану. Найважливішими з них є густина (або зв’язаний з нею питомий об’єм, що займає одиниця маси речовини), тиск і […]...
- Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 37 Тема. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції Цілі уроку: розвивати вміння й навички розрахунків за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції; повторити хімічні властивості класів неорганічних сполук, генетичний зв’язок між ними; підготувати учнів до тематичного оцінювання. Тип […]...
- Співвідношення об’ємів газів у хімічних реакціях. Обчислення об’ємних співвідношень газів за хімічними рівняннями Тема 3 НАЙВАЖЛИВІШІ ОРГАНІЧНІ СПОЛУКИ Урок 38 Тема уроку. Співвідношення об’ємів газів у хімічних реакціях. Обчислення об’ємних співвідношень газів за хімічними рівняннями Цілі уроку: формувати знання учнів про закон об’ємних співвідношень для газоподібних речовин на прикладі хімічних реакцій органічних речовин; формувати вміння застосовувати закон об’ємних співвідношень для розрахунків за хімічними рівняннями. Тип уроку: формування нових […]...
- РОЗЧИННІСТЬ РЕЧОВИНИ – ВОДА. ВОДНІ РОЗЧИНИ Хімія – універсальний довідник ВОДА. ВОДНІ РОЗЧИНИ РОЗЧИННІСТЬ РЕЧОВИНИ Під час утворення механічної суміші взаємодії між речовинами – компонентами суміші відсутні, тому речовини фізично можуть змішуватися у будь-яких кількісних співвідношеннях. Утворення хімічної сполуки в результаті хімічної реакції відповідно до закону сталості складу вимагає певних співвідношень речовин, що вступають у реакцію. Розчинення є фізико-хімічним процесом взаємодії […]...
- Відносна густина газів. Обчислення відносної густини Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 8 Тема. Відносна густина газів. Обчислення відносної густини Цілі уроку: розкрити суть поняття “відносна густина газів”; навчити учнів здійснювати розрахунки відносної густини газів, обчислення молярної маси за відомою відносною густиною; показати практичне значення цих розрахунків. Тип уроку: засвоєння нових знань. Форми роботи: розповідь учителя, керована практика, […]...