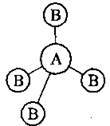
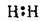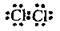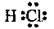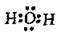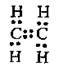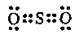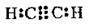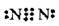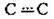Найважливіші характеристики ковалентного зв’язку
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
3. Хімічний зв’язок
3.6. Найважливіші характеристики ковалентного зв’язку
Характерні властивості ковалентного зв’язку – кратність, довжина, енергія, насиченість, спрямованість, полярність – визначають фізичні та хімічні властивості сполук.
Кратність зв’язку визначається кількістю спільних електронних пар, які зв’язують атоми. Відповідно ковалентний зв’язок буває простим (одинарним), подвійним і потрійним.
Приклади сполук з різною кратністю зв’язків:
Кратність | Назва зв’язку | Приклад речовини | Електронна формула | Графічна формула | Види зв’язків |
1 | Одинарний (простий) | Водень Н2 |
| H-H | Один σ-зв’язок |
Хлор Сl2 |
| Сl-Сl | |||
Хлороводень |
| Н-Сl | |||
Вода Н2O |
| H-O-H | Два σ-зв’язки | ||
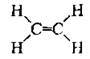
2 | Подвійний | Етен С2Н4 |
|
| П’ять σ-зв’язків (один С-С і чотири С-Н) та один π-зв’язок |
Сульфур(ІV) оксид SO2 |
| O=S=O | Два σ-зв’язки і два π-зв’язки | ||
3 | Потрійний | Етин С2Н2 |
| H-C≡C-H | Три σ-зв’язки (два С-Н і один С-С) та два π-зв’язки (С-С) |
Азот N2 |
| N≡N | Один σ-зв’язок, два π-зв’язки |
Довжина зв’язку – це відстань між центрами ядер атомів, які утворюють зв’язок. Її вимірюють у нанометрах (1 нм = 10-9 м). На довжину зв’язку істотно впливає кратність зв’язку: що вища кратність зв’язку, то менша довжина зв’язку. Зі збільшенням радіусів атомів, між якими виникає зв’язок, зростає і його довжина.
Енергія зв’язку – це енергія, яку потрібно затратити, щоб зруйнувати зв’язок, або енергія, яка виділяється при утворенні зв’язку. Її вимірюють у кілоджоулях на моль (кДж/моль). На енергію зв’язку істотно впливає кратність: що вища кратність зв’язку, то більша його енергія (міцність). Зі збільшенням міцності зв’язку його довжина зменшується.
Довжина та енергія зв’язків у молекулах деяких речовин:
Формула речовин | Атоми, між якими утворюється ковалентний зв’язок | Енергія зв’язку (кДж/моль) | Довжина зв’язку (нм) |
F2 | F-F | 159 | 0,142 |
Сl2 | Сl-Сl | 242 | 0,200 |
Вr2 | Вr-Вr | 192 | 0,229 |
І2 | I-І | 150 | 0,267 |
HF | H-F | 560 | 0,092 |
HCl | Н-Сl | 426 | 0,128 |
НВr | Н-Вr | 364 | 0,141 |
НІ | Н-І | 239 | 0,162 |
С2Н6 | С-С | 347 | 0,154 |
С6Н6 |
| 412 | 0,140 |
C2H4 | C=C | 606 | 0,134 |
C2H2 | C≡C | 831 | 0,120 |
Під насиченістю розуміють здатність атомів певного елемента утворювати обмежену кількість спільних ковалентних пар. Кількість ковалентних пар залежить від кількості орбіталей, що беруть участь у зв’язках. Так, наприклад, атом Нітрогену не може утворювати більше чотирьох зв’язків, атом Оксигену – більше трьох.
Залежно від того електрони яких підрівнів беруть участь у зв’язку (s, р чи гібридизованих орбіталей), його спрямованість по відношенню до лінії з’єднання атомів може бути різною.
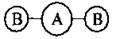
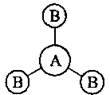
Якщо до складу молекули входить більше двох атомів, говорять про валентний кут, тобто про кут між уявними осями, проведеними через ядра сполучених атомів:
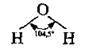
Характер гібридизації валентних орбіталей центрального атома та їхнє просторове розташування визначає просторову (геометричну) конфігурацію молекул та складних іонів:
Гібридизація орбіталей центрального атома | Валентний кут | Склад молекули | Геометрична будова молекули | Приклад |
Sp | 180° | AB2 | Лінійна | СO2, С2Н2, ВеСl2 |
Sp2 | 120° | АВ3 | Трикутна | ВСl3 |
Sp3 | 109°28′ | AB4 | Тетраедрична | СН4, CCl4, NH4+ |
Крім наведених варіантів просторового розміщення зв’язків, існують й інші (тригонально-біпірамідальна, пентагонально-біпірамідальна).
Як уже згадувалось вище, полярність зв’язку визначається асиметричністю розподілу спільної електронної хмари відносно ядер атомів, що утворюють зв’язок. Щільність електронної хмари зміщується у бік більш електронегативного елемента, внаслідок чого молекула набуває характеристик електричного диполя, тобто стає полярною.