Натрій і Калій – Елементи головної підгрупи І групи
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
8. Металічні елементи та їхні сполуки. Метали
8.2. Елементи головної підгрупи І групи1
8.2.2. Натрій і Калій
Натрій – 11-й елемент періодичної таблиці, заряд ядра – +11. Хімічний символ – Na. Природний Натрій складається з одного стабільного ізотопу – 23Na; відомо також 6 радіоактивних ізотопів. Калій – 19-й елемент періодичної таблиці, заряд ядра – +19. Хімічний символ – К. У природі є два стабільні ізотопи – 39К (93,3 %) і 41К
Електронні формули:
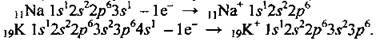
Поширеність Натрію і Калію в природі
Натрій і Калій – доволі поширені в природі елементи (кларки1 Натрію і Калію у земній корі становлять відповідно 25 і 24 кг/т), але внаслідок високої хімічної активності трапляються лише у вигляді сполук2. Входять до складу солей морської води, мінералів та
Натрій хлорид NaCl – основний компонент (77,8 %) морської солі3: Світовий океан містить 4 · 1015 т NaCl. З кожної тонни морської води можна отримати близько 1,3 кг NaCl. Натрій хлорид трапляється у вигляді мінералу галіту (становить 90 % кам ‘яної солі), який утворює кірки на стінках кратерів вулканів, а також потужні поклади в землі, товщина яких може сягати 100 м. Природними сполуками Натрію є також чилійська селітра NaNO3, мірабіліт (мінерал глауберової солі Na2SO4 · 10Н2O, один з найлегших природних мінералів, густина – 1,49 г/см3), бураNa2B4O7 · 10Н2O, польові шпати, нефелін і деякі інші силікати.
На частку солей Калію (КСl, K2SO4) припадає близько 5 % маси морської солі (або 380 мг йонів Калію на літр морської води). Калій міститься у складі декількох сотень мінералів: ортоклазу К2O · Аl2O3 · 6SiO2 (майже 18% маси земної кори)4, сильвіну КСl, сильвініту КСl · NaCl, карналіту КСl · MgCl2 · 6Н2O, каїніту КСl · MgSO4 · 3Н2O, калійної солі (багатокомпонентного мінералу, який містить усі вказані солі).
Йони К+ та Na+ входять до складу всіх клітин, беруть участь у багатьох життєво важливих процесах, зокрема підтриманні водного, електролітного, кислотно-лужного балансу.
Фізичні властивості натрію та калію
Натрій і калій легші за воду: густина – 0,97 і 0,856 г/см3 відповідно. Натрій має хорошу електро – і теплопровідність, температура плавлення – 97,86 °С, а кипіння – 883,15 °С, що й визначає (разом з відносною дешевизною добування) широту його застосування. Відносна молекулярна маса натрію – 23, молярна маса – 23 г/моль. Відносна молекулярна маса калію – 39, молярна Масі – 39 г/моль. Електронегативності Натрію і Калію за Полінгом становлять відповідно 0,93 і 0,82, Солі Натрію забарвлюють полум’я газового пальника в жовтий колір, солі Калію – в рожево-фіолетовий. Легко утворюють сплави із ртуттю (амальгами).
Добування натрію та калію
Натрій і калій одержують електролізом розплавів їхніх солей (хлоридів) та гідроксидів:
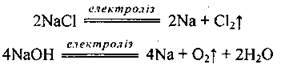
Крім того, калій добувають під час взаємодії натрію з калій хлоридом (реакцію проводять у розплаві).
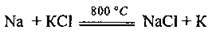
Хімічні властивості натрію та калію
1. Калій і натрій реагують з простими речовинами:
– з киснем повітря за нормальних умов, утворюючи натрій пероксид та калій надпероксид, а тому ці метали зберігають під шаром гасу, оскільки вони на повітрі енергійно реагують з киснем:
2Na + О2 = Na2О2
Також утворюється незначна кількість натрій оксиду:
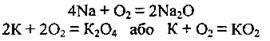
– з воднем, утворюючи гідриди; у гідридах ступінь окиснення Гідрогену становить -1:
2К + Н2= 2КН
Гідриди легко розкладаються водою з виділенням водню:
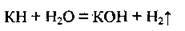
– з галогенами, у їхній атмосфері (F2, Сl2 та парів Вr2) самозаймаються, утворюючи галогеніди:
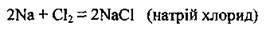
– з іншими неметалами – азотом, фосфором, сіркою – при нагріванні:
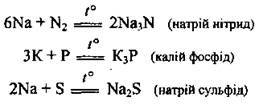
2. Калій і натрій реагують зі складними речовинами:
– з водою за нормальних умов енергійно (з вибухом):
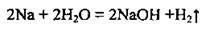
– з кислотами:
А) з кислотами, що є слабкими окисниками, утворюється сіль та виділяється водень:
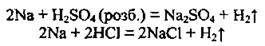
Б) з кислотами-окисниками (з вибухом), однак водень не утворюється:
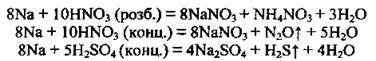
– з органічними речовинами:
А) зі спиртами:
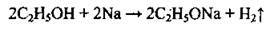
Б) з фенолом:
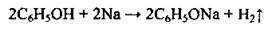
В) з галогеноалканами:
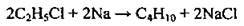
Застосування натрію і калію
Натрій як сильний відновник використовують у хімічній промисловості (відновлення вищих спиртів у виробництві синтетичних мийних засобів) та кольоровій металургії рідкісних металів (цирконію), а як каталізатор – у виробництві синтетичного (бутадієнового) каучуку. Його застосовують у машинобудуванні (виробництво підшипників), у виробництві тетраетилсвинцю (антидетонатора пального). Металічний натрій (а також його сплави з калієм, рубідієм, цезієм) використовують як теплоносій в атомних реакторах, клапанах авіаційних двигунів тощо. Натрій застосовують у виробництві газорозрядних ламп високого й низького тиску, які використовують у промисловості та для освітлення вулиць (жовте світло). Натрій використовують в аналітичній хімії. За його допомогою очищують речовини від слідів води.
Металічний калій, на відміну від натрію, не має суттєвого промислового значення. Його використовують як каталізатор у виробництві деяких видів синтетичного каучуку та в аналітичній хімії.
____________________________________________________________________
1 Кларкове число (або кларк) елемента – число, яке виражає середній склад хімічних елементів у земній корі, гідросфері, космічних тілах тощо стосовно загальної маси системи. Розрізняють масові (виражають у процентах, г/кг, кг/т) та атомні (у процентах від кількості атомів у системі) кларки.
2 У верхніх шарах атмосфери (близько 80 км) виявлено шар атомарного Натрію.
3 Морська сіль дещо відрізняється за смаком від кам’яної: гіркуватий присмак їй надають солі Магнію, концентрація ; яких трохи більша 15 %.
4 Ортоклаз, адуляр, мікроклін і санидін – речовини одного складу (KAlSi3O8), але різної структури, утворюють групу калієвих польових шпатів (КПШ).
