Оксид силіцію – ПІДГРУПА КАРБОНУ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 11. ПІДГРУПА КАРБОНУ
§ 11.6. Оксид силіцію( V ) та силікатна кислота
Оксид силіцію(ІV) називають також кремнеземом. Це тверда тугоплавка речовина, широко розповсюджена в природі у двох видозмінах: 1) кристалічний кремнезем – у вигляді мінералу кварцу і його різновидів (гірський кришталь, халцедон, агат, яшма, кремінь); кварц є основою кварцових пісків, які широко використовуються в будівництві та силікатній промисловості; 2) аморфний
Na2SiO3 + 2НСl = 2NaCl + Н2SiO3;
Н2SіО3 = Н2О + SiO2.
Силікагель має розвинену поверхню, а тому добре адсорбує вологу.
При 1 710°С кварц плавиться. За швидкого охолодження розплавленої маси утворюється кварцове скло. Воно має дуже малий коефіцієнт розширення, завдяки чому розжарене кварцове скло не тріскається при швидкому охолодженні водою. З кварцового скла виготовляють лабораторний
Найпростіша формула оксиду силіцію(ІV) SiO2 аналогічна формулі оксиду карбону(ІV) СО2. Проте їх фізичні властивості значно відрізняються (SіО2 – тверда речовина, СО2 – газ). Ця відмінність пояснюється будовою кристалічних решіток: СО2 кристалізується в молекулярній решітці, SiO2 – в атомній. Структуру SiO2 в площинному зображенні можна представити так:
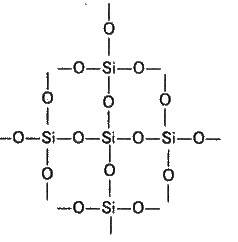
Координаційне число атома карбону в твердому СО2 дорівнює 2, а силіцію в SiO2 дорівнює 4. Кожний атом силіцію вміщений в тетраедр з 4 атомів оксигену. При цьому атом силіцію розташований у центрі, а у вершинах тетраедра розташовані атоми оксигену. Весь шматок кремнезему можна розглядати як кристал, формула якого (SiO2)n. Така будова оксиду силіцію(ІV) зумовлює його високу твердість та тугоплавкість.
За хімічними властивостями оксид силіцію(ІV) SіО2 належить до кислотних оксидів. При сплавлянні його з твердими лугами, основними оксидами і карбонатами утворюються солі силікатної кислоти:
SiO2 + 2NaOH = Na2SiO3 + Н2О;
SiO2 + CaO = СаSіО3;
SiO2 + Na2СО2 = Na2SiO3 + CO2.
З оксидом силіцію(ІV) взаємодіє тільки плавикова кислота:
SiO2 + 4HF = SiF4 + 2Н2О.
За допомогою цієї реакції здійснюють травлення скла. У воді оксид силіцію(ІV) не розчиняється і з нею хімічно не взаємодіє. Тому силікатну кислоту добувають непрямим способом, діючи кислотою на розчин силікату калію або натрію:
SiO2-3 + 2Н+ = H2SiO3.
При цьому силікатну кислоту (залежно від концентрації вихідних розчинів солі та кислоти) можна добути як у вигляді драглистої маси, що містить воду, так і у вигляді колоїдного розчину (золю).
Силікатна кислота побудована з тетраедричних структурних ланок (в кожній такій ланці атом силіцію розташований в центрі тетраедра, а у вершинах розміщені атоми оксигену). Структурні ланки, об’єднуючись в ланцюги, утворюють стійкіші полісилікатні кислоти:
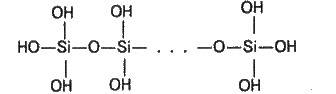
Склад такої сполуки можна виразити формулою (Н2SіО3)n. Проте звичайно силікатну кислоту зображують формулою Н2SiO3.
H2SiO3 – кислота дуже слабка, у воді малорозчинна. При нагріванні легко розкладається аналогічно карбонатній кислоті:
H2SiO3 = Н2О + SiO2.
Як двохосновна кислота, дисоціює ступінчасто:
H2SiO3 ⇆ Н+ + HSiO-3 і HSiO-3 ⇆Н+ + SiO2-3.
