Основні характеристики ковалентного зв’язку. Одинарні, подвійні, потрійні зв’язки
І СЕМЕСТР
Тема 2. ВУГЛЕВОДНІ
Урок 7
Тема уроку. Основні характеристики ковалентного зв’язку. Одинарні, подвійні, потрійні зв’язки
Цілі уроку: розвивати знання учнів про ковалентний карбон-карбоновий зв’язок на прикладі утворення? – та п-зв’язків атомами Карбону; ознайомити учнів з основними характеристиками ковалентного зв’язку (довжиною, енергією, полярністю, просторовою спрямованістю) на прикладі одинарного, подвійного, потрійного карбон-карбонового зв’язку; розширити знання про ковалентний карбон-карбоновий
Тип уроку: вивчення нового матеріалу.
Форми роботи: фронтальна робота, евристична бесіда, навчальна лекція, демонстраційний експеримент.
Обладнання: медіа-фрагмент про гібридизацію електронних орбіталей в атомі Карбону, моделі молекул вуглеводнів.
ХІД УРОКУ
I. Організація класу
II. Актуалізація опорних знань.
Мотивація навчальної діяльності
Фронтальна бесіда за запитаннями
¦ Який зв’язок називається а-зв’язком? п-зв’язком?
¦ Чим пояснити стійкість
¦ Чому молекула метану має тетраедричну форму?
¦ У чому відмінності між зв’язками C-H і C-C у молекулах вуглеводнів?
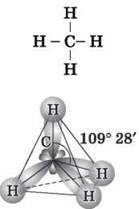
III. Вивчення нового матеріалу
1. Основні характеристики ковалентного зв’язку
Перша теорія ковалентного зв’язку належить американському фізико-хіміку Г.-Н. Льюїсу. У 1916 р. він припустив, що зв’язок між двома атомами здійснюється парою електронів, при цьому навколо кожного атома зазвичай формується восьми-електронна оболонка (правило октету).
¦ Які види хімічного зв’язку найчастіше трапляються в органічних сполуках?
Хімічний зв’язок – це взаємодія двох атомів, що відбувається шляхом обміну електронами. Під час утворення хімічного зв’язку атоми прагнуть здобути стійку восьми-електронну (або двох-електронну) зовнішню оболонку, що відповідає будові атома найближчого інертного газу. Розрізняють такі види хімічного зв’язку: ковалентний (полярний і неполярний; обмінний і донорно-акцепторний), іонний, водневий і металевий.
Найчастіше в органічних сполуках спостерігається ковалентний зв’язок.
Він здійснюється за рахунок електронної пари, що належить обом атомам. Розрізняють обмінний і донорно-акцепторний механізми утворення ковалентного зв’язку.
1) Обмінний механізм
Кожен атом віддає по одному неспареному електрону в спільну електронну пару:
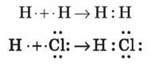
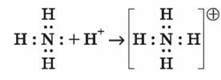
2) Донорно-акцепторний механізм
Один атом (донор) віддає електронну пару, а інший атом (акцептор) надає для цієї пари вільну орбіталь.
Два атоми можуть усуспільнювати кілька пар електронів. У цьому випадку говорять про кратні зв’язки:
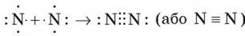 – потрійний зв’язок
– потрійний зв’язок
Якщо електронна густина розподілена симетрично між атомами, ковалентний зв’язок називається неполярним. Якщо електронна густина зміщена в бік одного з атомів, то ковалентний зв’язок називається полярним. Полярність зв’язку тим більша, чим більшою є різниця електронегативностей атомів.
Електронегативність – це здатність атома притягувати електронну густину від інших атомів. Найбільш електронегативним елементом є Флуор, найменша електронегативність – у Францію.
2. Іонний зв’язок
Іони – це заряджені частинки, на які перетворюються атоми в результаті віддачі або приєднання електронів.
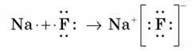
(Натрій флуорид складається з йонів Натрію Na+ та флуорид-іонов F-.)
Якщо різниця між електронегативностями атомів значна, то електронна пара, що здійснює зв’язок, переходить до одного з атомів, і обидва атоми перетворюються на іони.
Хімічний зв’язок між іонами, що здійснюється за рахунок електростатичного притягання, називається іонним зв’язком.
3. Водневий зв’язок
Водневий зв’язок – це зв’язок між позитивно зарядженим атомом Гідрогену однієї молекули й негативно зарядженим атомом іншої молекули. Водневий зв’язок має частково електростатичний, частково – донорно-акцепторний характер.
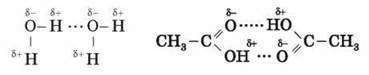
Водневий зв’язок зображено крапками.
Наявність водневих зв’язків пояснює високі температури кипіння води, спиртів, карбонових кислот.
4. Основні характеристики ковалентного зв’язку
Одна з важливих властивостей ковалентного зв’язку – її насичуваність. За обмеженої кількості зовнішніх електронів у ділянках між ядрами утворюється обмежене число електронних пар біля кожного атома (а отже, і число хімічних зв’язків). Саме це число тісно пов’язане з поняттям валентності атома в молекулі (валентністю називають загальне число ковалентних зв’язків, утворених атомом). Інша важлива властивість ковалентного зв’язку – її спрямованість у просторі. Це виявляється в приблизно однаковій геометричній будові близьких за складом хімічних частинок. Особливістю ковалентного зв’язку є також його здатність до поляризації.
Важливими кількісними характеристиками ковалентного зв’язку є енергія зв’язку, його довжина й дипольний момент.
– Енергія зв’язку – це енергія, що виділяється під час його утворення або необхідна для роз’єднання двох зв’язаних атомів. Енергія зв’язку характеризує його міцність.
– Довжина зв’язку – це відстань між центрами зв’язаних атомів. Чим менша довжина, тим більш міцним є хімічний зв’язок.
– Дипольний момент зв’язку (д) – векторна величина, що характеризує полярність зв’язку (вимірюється в дебаях (D) або кулон-метрах: 1D = 3,4 – 10-30 Кл-м).
Довжина вектора дорівнює добутку довжини зв’язку l на ефективний заряд q, який отримують атоми в результаті зсуву електронної густини: lµl = l – q. Вектор дипольного моменту спрямований від позитивного заряду в бік негативного. У результаті векторного додавання дипольних моментів усіх зв’язків одержують дипольний момент молекули.
На характеристику зв’язків впливає їхня кратність:
– енергія зв’язку збільшується в ряду: C – C < C = C < C = C;
– довжина зв’язку зростає у зворотному напрямі: C = C < C = C < C – C.
Порівняймо основні характеристики ковалентних зв’язків, що найчастіше трапляються в молекулах органічних сполук між атомами Карбону в різному стані гібридизації й атомами інших хімічних елементів.
Основні характеристики деяких ковалентних зв’язків
Зв’язок | Тип гібридизації атома Карбону | Енергія, кДж/моль | Довжина, нм | Дипольний момент, D |
C – C | Sp3 | 348 | 0,154 | 0 |
C = C | Sp2 | 620 | 0,133 | 0 |
C | Sp | 814 | 0,120 | 0 |
C – H | Sp3 | 414 | 0,110 | 0 |
C – H | Sp | 435 | 0,107 | 1,10 |
C – O | Sp3 | 344 | 0,143 | 1,10 |
C = O | Sp2 | 708 | 0,121 | 2,40 |
C – Cl | Sp3 | 331 | 0,176 | 2,05 |
C – Br | Sp3 | 277 | 0,194 | 2,04 |
C – N | Sp3 | 293 | 0,147 | 0,40 |
O – H | – | 460 | 0,096 | 1,51 |
N – H | – | 390 | 0,101 | 1,40 |
IV. Підбиття підсумків уроку
Визначте тип гібридизації атомів Карбону в сполуках і вид хімічного зв’язку між атомами в цих молекулах:
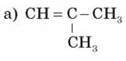
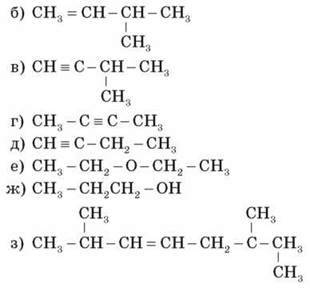
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
 C
C