Положення елементів-металів у періодичній системі, особливості будови атомів. Металічний зв’язок. Фізичні властивості металів
ІІ семестр
Тема 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (13 годин)
УРОК 23
Тема уроку. Положення елементів-металів у періодичній системі, особливості будови атомів. Металічний зв’язок. Фізичні властивості металів
Цілі уроку: поглибити знання учнів про металеві елементи, їх положення в періодичній системі, особливості будови атомів, будови речовини; ознайомити з типом хімічного зв’язку, властивим металам, – металічним зв’язком; показати вплив зв’язку на фізичні властивості речовин, утворених елементами-металами.
Тип
Форми роботи: навчальна лекція, евристична фронтальна бесіда, самостійна робота з опорною схемою, демонстраційний експеримент.
Обладнання: періодична таблиця хімічних елементів Д. І. Менделєєва, ряд активності металів, колекції металів та їх сплавів, модель металевої кристалічної гратки.
Демонстрація 4. Ознайомлення зі зразками металів і сплавів.
ХІД УРОКУ
І. Організація класу
II. Мотивація навчальної діяльності, актуалізація опорних знань
Фронтальна робота за питаннями
У 7 класі ми вже ознайомилися з металами на прикладі заліза – однієї з найпоширеніших
– Яких елементів у природі більше: металів чи неметалів?
– Де в періодичній системі знаходяться елементи-метали?
– Назвіть особливості будови металічних елементів.
– Назвіть характерні ступені окиснення елементів-металів? (Типові: +1, +2, рідше: +3, +4. Як правило, для металів зі змінною валентністю в сполуках з вищим ступенем окиснення металу проявляються амфотерні властивості)
Троє учнів біля дошки складають схеми будови атомів Натрію Na, Магнію Mg, Алюмінію Al.
Отже, об’єкт нашого вивчення на сьогоднішньому уроці – металічні елементи:
– особливості будови атомів металів;
– будова простих речовин-металів;
– фізичні властивості металів.
III. Вивчення нового матеріалу
Навчальна лекція, робота зі схемою
1. Положення металів у періодичній системі, будова атомів
Характеризуються незначною електронегативністю, легко віддають електрони, атоми металів можуть лише окислюватися:
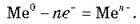
2. Металічний зв’язок
(Розглядаємо модель кристалічної гратки.)
Зумовлений особливостями будови атомів металів, у вузлах граток – атоми й катіони металу, між вузлами – відносно вільні електрони. (Записуємо визначення.)
3. Загальні фізичні властивості металів
Зумовлені наявністю вільних електронів у кристалічних гратках металів; високою міцністю й рухливістю металічного зв’язку.
(Розглядаємо колекції металів.)
Під час евристичної бесіди на підставі знань учнів, їхніх спостережень у побуті й розглянутих зразків металів робимо висновки про фізичні властивості металів:
– Агрегатний стан (тверді за н. у., за винятком Hg).
– Колір: усі відтінки від світло-сірого до темно-сірого (винятки: Cu, Au).
– Тепло – і електропровідність (за рахунок вільних електронів) збільшуються в ряді Hg, Pb, Fe, Zn, Mg, Al, Au, Cu, Ag.
– Чому в радіотехніці для виготовлення точних приладів використовують срібло й мідь?
– З якого металу найбільш вигідно виготовляти опалювальні системи?
– Ковкість і пластичність. (Розглядаємо рисунок у підручнику або переглядаємо медіа-фрагмент зміщення атомів та іонів металів у кристалічних гратках унаслідок деформації.) Йони безпосередньо один з одним не зв’язані, тому окремі їх шари можуть зміщатися один відносно одного. Найбільш пластичний метал – золото. Найбільш крихкими є хром, манган, стибій (на зовнішньому рівні – п’ять-сім електронів, чимала кількість вільних електронів забезпечує міцність окремих шарів іонів і перешкоджає їх вільному ковзанню).
– Густина: легкі – ? < 5 г/см3 (?(Li) = 0,53 г/см3); важкі – ? > 5 г/см3 (?(Оs) = 22,48 г/см3).
– Твердість: м’які (лужні метали); тверді (хром).
– Температура плавлення: легкоплавкі – tпл(Hg) = -38,87 °С; тугоплавкі – tпл(W) = 3 370 °С.
– Температура кипіння в металів висока.
IV. Первинне застосування отриманих знань
1. Самостійна робота зі схемою
2. Узагальнююча бесіда
– Чим зумовлені істотні відмінності між властивостями атомів металів і неметалів?
– Чому в металічних елементів значно більше загальних фізичних властивостей, ніж у неметалічних, у яких фізичні властивості значною мірою відрізняються?
– Які прості речовини-метали застосовуються найбільше?
– На яких фізичних властивостях грунтується це застосування?
– Спрогнозуйте хімічні властиві металів.
V. Підбиття підсумків
Учитель пропонує двом-трьом учням підбити підсумки уроку, назвати основні питання, розглянуті на уроці, оцінює роботу учнів.
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання.
Творче завдання: підготувати повідомлення про поширення металів у природі.
