Поняття ентропії – Рушійна сила хімічних реакцій
ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ
3. Рушійна сила хімічних реакцій
Досвід показує, що будь-яка система твердих тіл або речовин завжди прагне перейти у стан з найменшою енергією. Це явище відповідає принципу найменшої енергії.
Приклад. Якщо рідку воду винести взимку на холод, то вона перетворюється на твердий лід з виділенням енергії, бо при температурі нижче 0 °С вода має меншу внутрішню енергію, ніж у рідкому стані.
З досліду можна також побачити, що теплота прагне перерозподілитися. Це явище називають вирівнюванням теплоти.
Приклад.
3.1 . Поняття ентропії
Тенденція до розподілу є не лише властивістю енергії теплоти, це властиво й речовинам.
Приклад. Якщо декілька крапель брому капнути на днище циліндра, заповненого повітрям, то пари брому мимоволі змішуються з повітрям доти, доки він не розподілиться в циліндрі рівномірно.
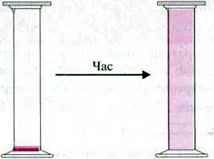
При змішуванні брому з повітрям відбувається
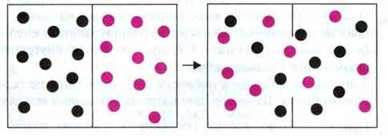
Мірилом безладу системи є ентропія S. Чим менший порядок, тим більша ентропія.
Приклад. У твердій речовині частинки впорядковані в гратці рівномірно, при плавленні цей впорядкований стан переходить у неврегульований стан рідини – ентропія речовини збільшується.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Ентропія реакції – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.3. Ентропія реакції У кожній реакції впорядкований стан системи змінюється і, отже, змінюється ентропія. Зміна ентропії реакції ∆SR, як і ентальпії реакції, визначається як різниця суми ентропій продуктів реакції і суми ентропій початкових речовин: Приклад. Під час реакції газоподібного гідроген хлориду з газоподібним амоніаком з двох “невпорядкованих” […]...
- Ентропія простих речовин і сполук – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.2 . Ентропія простих речовин і сполук Прийнято вважати, що атоми елементів і сполук при абсолютному нулі (тобто при 0 К або -273,16 °С) знаходяться в абсолютно впорядкованому стані. Ентропія речовин при абсолютному нулі становить S = 0 Дж/(моль ∙ К). При підвищенні температури порядок у структурі […]...
- Вільна енергія реакції Гіббса – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.4. Вільна енергія реакції Гіббса Кожна реакція характеризується двома тенденціями: – система речовин прагне перейти у стан з якомога меншою ентальпією; – система речовин прагне перейти в стан з якомога більшою ентропією. Тому реакція Проходить самочинно в той бік, де знижується ентальпія реакції і зростає її ентропія. […]...
- Зворотність реакції – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.5 . Зворотність реакції Відповідно до рівняння Гіббса-Гельмгольца, вільна енергія реакції ∆G0R залежить від температури. Якщо не враховувати залежність температури від ∆H0R і ∆S0R, то рівняння Гіббса-Гельмгольца відповідає рівнянню прямої. Залежно від знаків ∆H0R і ∆S0R розрізняють чотири типи реакції. Тип 1: при температурі Т < Т0 […]...
- Тема 4. Закономірності перебігу хімічних реакцій – ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Тема 4. Закономірності перебігу хімічних реакцій Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Позначте назву реакцій, що перебігають з виділенням теплоти: A. Ендотермічні; Б. Оборотні; В. Необоротні; Г. Екзотермічні. 2. Позначте вірне […]...
- Енергетика хімічних реакцій. Тепловий ефект реакції – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.4. Енергетика хімічних реакцій. Тепловий ефект реакції Як відомо із закону збереження енергії, енергія не виникає з нічого і не зникає безслідно. Речовини, що вступають у хімічну реакцію (реагенти), мають певний запас енергії (внутрішньої енергії). Під час хімічної реакції руйнуються […]...
- РЕАКЦІЇ СПОЛУЧЕННЯ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ СПОЛУЧЕННЯ Уже сама назва “реакція сполучення” говорить про її тип. У результаті сполучення декількох речовин утворюється одна нова речовина. Практично завжди в реакцію сполучення вступає не більше двох речовин; ці речовини можуть бути як простими, так і складними. Приклади реакцій сполучення: У переважній більшості реакції сполучення є […]...
- Енергетичний ефект хімічних реакцій Хімія Загальна хімія Хімічні реакції Енергетичний ефект хімічних реакцій Хімічні реакції завжди супроводжуються виділенням або поглинанням енергії. Кількість виділеної або поглиненої енергії називається тепловим ефектом хімічної реакції (Q). Реакції, що супроводжуються виділенням енергії, називаються екзотермічнимИ, поглинанням енергії, – ендотермічнимИ. Хімічні рівняння, в яких наводяться теплові ефекти хімічних реакцій, називаються ТермохімічнимИ, наприклад: У цьому рівнянні зазначені […]...
- Ентальпія утворення простих речовин – Перетворення енергії в хімічних реакціях ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 1 . Перетворення енергії в хімічних реакціях 1.2 . Ентальпія утворення простих речовин Прості речовини складаються з атомів одного виду, які залежно від агрегатного стану і виду простих речовин з’єднуються між собою по-різному. Утворення молекул або іонів з окремих атомів, кристалічних граток з іонів або молекул енергія кристалічної гратки, також пов’язане з […]...
- РЕАКЦІЇ ОБМІНУ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ ОБМІНУ Реакції між складними хімічними речовинами, в результаті яких відбувається обмін між ними окремими атомами або групами атомів, називаються реакціями обміну. Наприклад: Реакції обміну (крім сильно екзотермічної реакції нейтралізації) зазвичай супроводжуються невеликим тепловим ефектом, тобто відбувається лише невелика зміна внутрішньої енергії системи, і вона не може бути […]...
- Швидкість хімічних реакцій ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.1. Швидкість хімічних реакцій Суть хімічних реакцій зводиться до розриву зв’язків у вихідних речовинах і виникнення нових зв’язків у продуктах реакції. При цьому загальне число атомів кожного елемента до і після реакції залишається сталим. Оскільки утворення […]...
- СХЕМА ХІМІЧНОЇ РЕАКЦІЇ. РІВНЯННЯ ХІМІЧНИХ РЕАКЦІЙ № 1. Хімічне рівняння – це умовний запис хімічної реакції (хімічного явища) за допомогою хімічних формул, коефіцієнтів і знаків “+” “-” та “=”. Знак “=” вказує на те, що кількість атомів кожного хімічного елемента у лівій та правій частині хімічного рівняння однакова. № 2. Рівняння хімічної реакції відрізняється від її схеми тим, що у рівнянні […]...
- Рівняння хімічних реакцій. Закон збереження маси речовин у хімічних реакціях Контрольні запитання № 1. Маси речовин, що вступають у реакцію, дорівнюють масі утворених речовин, про що свідчить закон збереження маси в хімічних реакціях. Цей закон підкріплений тим, що атоми в хімічних реакціях не зникають, а просто переходять з одних речовин до складу інших. За допомогою хімічних символів і знаків закон збереження маси відображають рівнянням хімічної […]...
- РЕАКЦІЇ РОЗКЛАДУ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ РОЗКЛАДУ З назви “реакція розкладу” також випливає, про який тип реакцій іде мова. У реакції розкладу відбувається розкладання складної речовини на декілька речовин. Продуктами реакції можуть бути як прості, так і складні речовини. Наприклад: Майже всі вказані реакції, як і переважна більшість інших реакцій розкладу, ендотермічні. Для […]...
- РОЗРАХУНКИ ЗА РІВНЯННЯМИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник КІЛЬКІСНІ ВІДНОШЕННЯ В ХІМІЇ РОЗРАХУНКИ ЗА РІВНЯННЯМИ ХІМІЧНИХ РЕАКЦІЙ Розглянемо наступний приклад: обчислимо масу метану, необхідного для виробництва 1000 т сажі. Розв’язання хімічної задачі має починатися із запису рівняння реакції: Над формулами речовин, кількості яких (або якої) дані в умові задачі, зазначимо ці кількості й позначимо літерою х кількість речовини, що […]...
- Ентальпія реакції – Перетворення енергії в хімічних реакціях ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 1 . Перетворення енергії в хімічних реакціях 1.3 . Ентальпія реакції Енергію, що виділилася або була поглинута в ході хімічної реакції, називають ентальпією реакції ∆HR або тепловим ефектом реакції. Значення цієї енергії легко визначити, якщо відомі ентальпії утворення ∆Hf відповідних речовин, що беруть участь у реакції. Тепловим ефектом реакції є різниця енергії […]...
- ЗАКОН ЗБЕРЕЖЕННЯ МАСИ РЕЧОВИН ПІД ЧАС ХІМІЧНИХ РЕАКЦІЙ № 1. Помилка попередників М. В. Ломоносова щодо прожарювання речовин полягала в тому, що перед проведенням дослідів реторту (з уміщеним у неї свинцем) зважували і запаювали. По завершенні дослідів реторту відкривали і повторювали зважування, виявляли збільшення маси. Про те, що у реторті, крім металу, було повітря, а в ньому кисень, який вступав у хімічну реакцію […]...
- Типи хімічних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.3. Типи хімічних реакцій Хімічні реакції класифікують за різними ознаками: – за фазовим станом середовища; – за типом перетворення реагентів; – за тепловим ефектом; – за ознакою зміни ступенів окиснення; – за оборотністю. Фазовий стан середовища Залежно від фазового стану […]...
- Хімічна рівновага – Оборотність хімічних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.9. Оборотність хімічних реакцій За цією ознакою розрізняють: – реакції, які за однакових умов відбуваються у двох протилежних напрямках, називають оборотними. Наприклад, реакція синтезу сульфур(VI) оксиду (знак вказує саме на оборотність реакції): – необоротними називають реакції, які відбуваються тільки в […]...
- Класифікація хімічних реакцій – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Класифікація хімічних реакцій Класифікація за числом та складом вихідних реагентів і продуктів реакції Реакція сполучення – реакція, внаслідок якої з кількох речовин з відносно простим складом утворюється одна велика речовина з більш складною структурою. А + В […]...
- ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ – КИСЕНЬ Хімія – універсальний довідник КИСЕНЬ ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ Швидкість реакції – це кількість речовини, що реагує за одиницю часу. Залежно від умов одна і та ж реакція може протікати з різною швидкістю. Так, при збільшенні кількості речовини, що реагує в одиниці об’єму, тобто його концентрації, швидкість реакції зростає, тому що зростає число зіткнень частинок, що […]...
- Раціоналізаторські пропозиції-рушійна сила розвитку виробництва. Винахідництво РОЗДІЛ 1. ПРОЕКТУВАННЯ ЯК СКЛАДОВА СУЧАСНОГО ВИРОБНИЦТВА Й ЖИТТЄДІЯЛЬНОСТІ ЛЮДИНИ § 4 Раціоналізаторські пропозиції-рушійна сила розвитку виробництва. Винахідництво У широкому розумінні термін “раціоналізація” означає поліпшення чи вдосконалення певного процесу, об’єкта тощо. Зокрема, для техніки, промислового виробництва – це вдосконалення технічних об’єктів, пристосувань, знарядь праці, технології виготовлення деталей, пристроїв, випуску продуктів харчування тощо. Проблема участі у […]...
- ПРИРОДНИЙ ДОБІР – РУШІЙНА СИЛА ЕВОЛЮЦІЇ Біологія – універсальний довідник ЗАГАЛЬНА БІОЛОГІЯ ЕВОЛЮЦІЯ. ЕВОЛЮЦІЙНЕ ВЧЕННЯ ПРИРОДНИЙ ДОБІР – РУШІЙНА СИЛА ЕВОЛЮЦІЇ Природний добір – це процес, спрямований на збереження і розмноження в ряді поколінь організмів, що мають корисні для їх життя і розвитку адаптивні ознаки, і знищення менш пристосованих. Більш пристосовані особини мають можливість залишити потомство. Матеріалом для добору служать індивідуальні […]...
- ЗАКОН ЗБЕРЕЖЕННЯ МАСИ РЕЧОВИН ПІД ЧАС ХІМІЧНИХ РЕАКЦІЙ Тема 2 КИСЕНЬ & 23. ЗАКОН ЗБЕРЕЖЕННЯ МАСИ РЕЧОВИН ПІД ЧАС ХІМІЧНИХ РЕАКЦІЙ Вивчення параграфа допоможе вам: · пізнати сутність одного з основних законів хімії – закону збереження маси речовин; · пояснювати сутність закону збереження маси речовин Ви вже знаєте, що хімічні явища супроводжуються утворенням нових речовин. Відбувається це з атомів тих самих елементів, що […]...
- КАТАЛІЗ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ КАТАЛІЗ Каталіз – це зміна швидкості хімічної реакції речовинами (каталізаторами), які беруть участь у реакції, але не входять до складу кінцевих продуктів. За участю каталізатора хімічна рівновага системи досягається швидше, ніж без нього. Вплив у каталізатора на швидкість реакції досягають за рахунок […]...
- Розрахунки за рівняннями хімічних реакцій – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач II. Розрахунки за рівняннями хімічних реакцій Задача 7. Який об’єм водню (н. у.) витратиться на відновлення 0,4 моль хром(ІІІ) оксиду? Дано: Розв’язання Запишемо рівняння реакції: 1. З написаного рівняння видно, що 2. Для знаходження об’єму водню […]...
- Розрахунки за рівняннями хімічних реакцій між розчином солі та металом РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ § 53. Розрахунки за рівняннями хімічних реакцій між розчином солі та металом Усвідомлення змісту цього параграфа дає змогу: Пояснювати суть і причини зміни маси пластинки в зазначених реакціях; Розв’язувати задачі “на пластинку”. Задачі такого типу засновані на закономірностях витискувального ряду металів. Як ви уже знаєте, показником порівняльної хімічної […]...
- СХЕМА ХІМІЧНОЇ РЕАКЦІЇ. РІВНЯННЯ ХІМІЧНИХ РЕАКЦІЙ Тема 2 КИСЕНЬ & 24. СХЕМА ХІМІЧНОЇ РЕАКЦІЇ. РІВНЯННЯ ХІМІЧНИХ РЕАКЦІЙ Вивчення параграфа допоможе вам: · пояснювати суть рівнянь хімічних реакцій; · розрізняти схему і рівняння хімічної реакції, коефіцієнти й індекси; · у рівняннях хімічних реакцій розрізняти реагенти і продукти реакцій; · писати рівняння хімічних реакцій з дотриманням закону збереження маси речовин До цього часу […]...
- Типи реакцій в органічній хімії ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ III. ОРГАНІЧНА ХІМІЯ 10. Теоретичні основи органічної хімії 10.9. Типи реакцій в органічній хімії 1. За результатами реакції розрізняють: Тип реакції Приклад Що відбувається Заміщення У молекулі вихідної речовини заміщуються окремі атоми Розкладання (крекінг) Розрив зв’язку С-С Відщеплення (елімінування) Відщеплення двох атомів чи груп атомів від […]...
- РЕАКЦІЇ ЗАМІЩЕННЯ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ ЗАМІЩЕННЯ Реакції між простою і складною речовиною, в результаті яких атоми простої речовини заміщають атоми одного з елементів складної речовини, називаються реакціями заміщення. Наприклад: Рушійною силою реакцій заміщення є утворення більш міцних сполук. З хімічної точки зору чим активніший хімічний елемент, тим міцніші сполуки він утворює, і […]...
- Класифікація хімічних реакцій за різними ознаками Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 21 Тема уроку. Класифікація хімічних реакцій за різними ознаками Цілі уроку: узагальнити й систематизувати знання учнів про хімічні реакції; розвивати вміння й навички визначення типів хімічних реакцій за рівняннями хімічних реакцій; формувати знання учнів про хімічні рівняння на прикладі класифікації рівнянь реакції за тепловим ефектом, наявністю каталізатора, зміною ступенів окиснення […]...
- ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ Швидкість і механізм хімічної реакції вивчає хімічна кінетика. Швидкість хімічної реакції характеризується зміною концентрації однієї з вихідних речовин або кінцевих продуктів за одиницю часу. Середня швидкість реакції: Де с1 і с2 – початкова і кінцева концентрація речовини; τ1 і […]...
- Ентальпія утворення сполук – Перетворення енергії в хімічних реакціях ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 1 . Перетворення енергії в хімічних реакціях Практично в усіх хімічних реакціях відбувається взаємне перетворення різних видів енергії. Найчастіше енергія виділяється або поглинається у вигляді теплоти. Якщо в ході реакції енергія виділяється, то таку реакцію називають екзотермічною, якщо енергія поглинається, то таку реакцію називають ендотермічною реакцією. Приклад. Магній реагує з киснем, утворюючи […]...
- ЕНЕРГІЯ АКТИВАЦІЇ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ ЕНЕРГІЯ АКТИВАЦІЇ Енергія активації Еа – надлишкова енергія, яку повинні мати молекули, щоб у результаті їхнього зіткнення відбулася хімічна реакція. Хімічна реакція Здійснюється через утворення активованого комплексу А2 … В2, в якому відбувається перегрупування атомів (рис. 44): Рис. 44. Енергетична схема проходження […]...
- Хімічні реакції. Класифікація реакцій ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ § 1.8. Хімічні реакції. Класифікація реакцій Речовини, взаємодіючи одна з одною, зазнають різних змін і перетворень. Наприклад, берилій, взаємодіючи з оксигеном повітря за температури понад 500°С, перетворюється на оксид берилію; вугілля, згоряючи, утворює вуглекислий газ […]...
- Характеристика хімічних елементів – ГАЛОГЕНИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЯ ЕЛЕМЕНТІВ ГАЛОГЕНИ Характеристика хімічних елементів Властивості хімічних елементів Властивість Флуор Хлор Бром Йод Хімічний символ F Сl Вr І Порядковий номер 9 17 35 85 Атомна маса 18,99840 35,453 79,904 126,9045 Місце в ПС 2 період; VII група 3 період; VII група […]...
- Розрахунки за термохімічними рівняннями реакцій РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ IVA ГРУПИ § 46. Розрахунки за термохімічними рівняннями реакцій Усвідомлення змісту цього параграфа дає змогу: обчислювати теплові ефекти хімічних реакцій; Розв’язувати розрахункові задачі за термохімічними рівняннями реакцій. Для обчислень за термохімічними рівняннями реакцій потрібно знати таке. 1. Термохімічними називаються рівняння хімічних реакцій, у яких зазначається тепловий […]...
- Сила Лоренца 1-й семестр ЕЛЕКТРОДИНАМІКА 3. Електромагнітне поле УРОК 3/30 Тема. Сила Лоренца Мета уроку: розглянути дія магнітного поля на рухомі заряджені частинки. Тип уроку: урок вивчення нового матеріалу. ПЛАН УРОКУ Контроль знань 4 хв. 1. Модуль і напрямок сили Ампера. 2. Рамка зі струмом у магнітному полі. 3. Як працює двигун постійного струму. Демонстрації 2 хв. […]...
- Сила Ампера й сила Лоренца ЕЛЕКТРОДИНАМІКА Електромагнітне поле УРОК 3/15 Тема. Сила Ампера й сила Лоренца Мета уроку: розглянути дію магнітного поля на провідник зі струмом і на заряджені рухомі частинки. Тип уроку: урок вивчення нового матеріалу. ПЛАН УРОКУ Контроль знань 5 хв. 1. Що таке магнітне поле? 2. Як визначають модуль вектора магнітної індукції? 3. Як визначають напрямок вектора […]...
- Поняття про колоїдні розчини – ПІДГРУПА КАРБОНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 11. ПІДГРУПА КАРБОНУ § 11.7. Поняття про колоїдні розчини У природі і техніці часто трапляються дисперсні системи, в яких одна речовина рівномірно розподілена у вигляді частинок всередині іншої речовини. В дисперсних системах розрізняють дисперсну фазу – тонко подрібнену речовину і дисперсійне […]...