Порядок реакції – Вираження швидкості реакції
ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ
3. Вираження швидкості реакції
3.2 . Порядок реакції
На основі теорії зіткнення для різних типів молекулярних реакцій можна записати вирази для швидкості реакції:
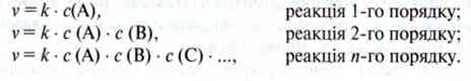
Константа k – константа швидкості реакції.
Через спільний вплив різних чинників на швидкість реакції результати експериментів часто не відповідають теоретичним припущенням. Тому певна реакція описується експериментально виведеним рівнянням (виразом) швидкості реакції:
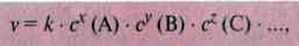
X
Приклад.
Порядок = сума показників рівня | Рівняння для швидкості реакції | Наприклад |
1 | ν = k ∙ с(А) | Радіоактивний розпад |
2 2 | ν = k ∙ с(А) ∙ с(В) ν = k ∙ с2(А) | Н2 + І2 → 2 НІ 2NO2 → N2O4 |
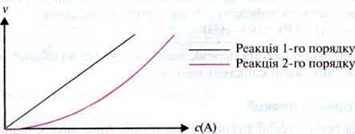
Реакції 1-го порядку порівняно рідкісні. Вони відбуваються лише з речовинами, які розпадаються на складові частини без впливу інших речовин.
Проте певні бімолекулярні реакції можна
Такі реакції називають реакціями псевдопершого порядку.
Приклад. Водний розчин кристалічного фіолету (кристал-віолету) (трифенілметанові барвники) знебарвлюється гідроксид-іонами:

Цей процес відповідає реакції 1-го порядку, якщо концентрація гідроксид-іонів порівняно з кристалічно фіолетовим (кристал-віолетом) дуже велика й може розглядатися як незмінна.
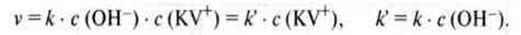




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Молекулярність реакції – Вираження швидкості реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 3. Вираження швидкості реакції Згідно з теорією зіткнення, збільшення вдвічі кількості частинок реагенту в певному об’ємі веде до збільшення кількості зіткнень вдвічі і, відповідно, до збільшення швидкості реакції вдвічі. При збільшенні втричі концентрації частинок відбувається збільшення швидкості реакції втричі і т. д. 3.1 . Молекулярність реакції Реакції, в яких від початкових речовин […]...
- Опис швидкості реакції – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.3 . Опис швидкості реакції Швидкість реакції можна описати як зміну концентрації початкової речовини і як зміну продукту реакції за певний проміжок часу. І в одному і в іншому випадку за певний проміжок часу вона визначається за кутом нахилу січної відповідного графіка с(t). В один і той самий проміжок […]...
- Швидкість хімічної реакції – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Швидкість хімічної реакції Хімічні реакції відрізняються одна від одної тривалістю їхнього протікання. Деякі хімічні реакції відбуваються миттєво (наприклад, вибух воднево-кисневої суміші, реакції обміну з утворенням осаду), інші – досить швидко (горіння речовин), треті – повільно (більшість реакцій […]...
- Швидкість хімічної реакції – Хімічні реакції Хімія Загальна хімія Хімічні реакції Швидкість хімічної реакції Швидкість хімічної реакції Визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму. Формула середньої швидкості хімічної реакції: де – середня швидкість хімічної реакції, – зміна концентрації реагенту, – час. Чинники, що впливають на швидкість хімічної реакції 1) Природа реагуючих речовин. 2) Агрегатний стан реагуючих речовин. […]...
- Швидкість хімічної реакції, залежність швидкості реакції від різних факторів Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 23 Тема уроку. Швидкість хімічної реакції, залежність швидкості реакції від різних факторів Цілі уроку: формувати уявлення учнів про швидкість хімічної реакції, вплив на неї різних факторів; показати залежність швидкості хімічної реакції від природи речовини, температури, концентрації; розвивати навички й уміння складати рівняння хімічних реакцій, розпізнавати типи реакцій за рівняннями реакції; […]...
- Чинники, що визначають швидкість реакції – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.4 . Чинники, що визначають швидкість реакції Згідно з теорією зіткнення, реакція відбувається лише за певних умов: – частинки, які реагують між собою, повинні зіштовхнутися одна з одною; – частинки повинні зіштовхуватися в сприятливому для них положенні; – частинки повинні мати достатню кінетичну енергію, оскільки реакція проходить лише при […]...
- Фактори, що впливають на швидкість реакції ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.2. Фактори, що впливають на швидкість реакції Швидкість хімічної реакції залежить від природи речовин, що реагують, і умов перебігу реакції: концентрації с, температури t, наявності каталізаторів, а також від деяких інших факторів (наприклад, від тиску – […]...
- ОБОРОТНІ РЕАКЦІЇ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ ОБОРОТНІ РЕАКЦІЇ Реакція дисоціації води, рівняння якої наведено у попередньому параграфі, протікає незначною мірою. З кожного мільярда молекул води в ній беруть участь лише дві, тому концентрація кожного з іонів, які утворюються, мізерно мала (10-7 моль/л). Коли кажуть, що вода – слабкий електроліт, то мають на увазі, що вона слабко […]...
- Водневий показник – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.2. Водневий показник У водних розчинах електролітів (кислот, основ) іонний добуток води залишається практично незмінним, поки їх концентрація не стане дуже великою. Отже, якщо концентрація с(Н3О+) у розчині більша, ніж у чистій воді, то с(ОН-) повинна бути менша, і навпаки. Приклад. Рівновага НСl + Н2O Н3O+ + Сl – […]...
- Хімічні реакції. Окисно-відновні реакції I СЕМЕСТР ПОВТОРЕННЯ ОСНОВНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ (4 год.) УРОК 4 Тема уроку. Хімічні реакції. Окисно-відновні реакції Цілі уроку: актуалізувати знання учнів про хімічні реакції; удосконалювати вміння й навички складання повних і скорочених іонно-молекулярних та окисно-відновних рівнянь реакції; узагальнити уявлення учнів про швидкість хімічної реакції, хімічну рівновагу й фактори, що впливають на швидкість […]...
- Визначення – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції У ході хімічної реакції кількість початкових речовин постійно зменшується, а кількість продуктів реакції відповідно збільшується. Зміну кількості початкових речовин чи продуктів реакції за певний проміжок часу називають швидкістю реакції. 2.1. Визначення Швидкість реакції v визначається як зміна кількості п речовини за певний проміжок часу: ∆n – зміна кількості речовини […]...
- Радикальне заміщення – Радикальні реакції ОРГАНІЧНІ РЕАКЦІЇ 2. Радикальні реакції Радикали мають високу реакційну здатність і в реакції з молекулами реагенту утворюють нові радикали, які у свою чергу утворюють нові радикали і т. д. У результаті відбувається ланцюгова реакція, в якій світло або теплова енергія, що поступає, дають лише “початковий поштовх”. Після запуску ланцюгової реакції радикалів вона може повторюватися декілька […]...
- ВПЛИВ ТЕМПЕРАТУРИ НА НАПРЯМОК ХІМІЧНОЇ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ВПЛИВ ТЕМПЕРАТУРИ НА НАПРЯМОК ХІМІЧНОЇ РЕАКЦІЇ Згідно з рівнянням На значення ΔG великий вплив має температура. Цей вплив визначається знаком і величиною ΔS. При ΔS > 0 з підвищенням температури (збільшенням Т) негативне значення ΔG буде зменшуватися, а при ΔS < 0 – збільшуватися. Приклад реакції, […]...
- ТЕПЛОВИЙ ЕФЕКТ РЕАКЦІЇ. ЕНТАЛЬПІЯ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ТЕПЛОВИЙ ЕФЕКТ РЕАКЦІЇ. ЕНТАЛЬПІЯ РЕАКЦІЇ Кількість теплоти Q, яку передали системі, йде на зміну її внутрішньої енергії ΔUі на здійснення системою роботи* W проти зовнішніх сил (зовнішнього тиску р) (рис. 32): Рис. 32. Робота, яку виконує хімічна система проти зовнішнього тиску (поршень невагомий). Вуглекислий газ, який […]...
- Середня і миттєва швидкість – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.2 . Середня і миттєва швидкість У ході реакції її швидкість зазвичай зменшується. Тобто швидкість реакції непостійна. Наведені вище значення швидкості є лише середніми значеннями. Математично середня швидкість у певному інтервалі часу між t1 і t2 визначається з нахилу січної на діаграмі залежності концентрації від часу. Увага: при експериментальному […]...
- Вплив середовища на характер перебігу реакцій – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.4. Вплив середовища на характер перебігу реакцій Реакції окиснення – відновлення можуть відбуватися в різних середовищах: у кислому (надлишок Н+-іонів), нейтральному (Н2О) і лужному (надлишок гідроксид-іонів ОН – ). Залежно від середовища може змінюватись і характер […]...
- РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ У розчинах електролітів у хімічну взаємодію вступають іони. З’ясуємо, у яких випадках це відбувається. Якщо змішати водні розчини кухонної солі (хлориду натрію) і вапняної води (розчину гідроксиду кальцію), то зовнішніх змін не спостерігається. Формально можна написати З огляду на те, що всі чотири речовини (хлорид і […]...
- ПОНЯТТЯ ПРО ШВИДКІСТЬ. ЗАДАЧІ НА ЗНАХОДЖЕННЯ ШВИДКОСТІ РУХУ. ЗАЛЕЖНІСТЬ ШВИДКОСТІ ВІД ЗМІНИ ВІДСТАНІ ПРИ СТАЛОМУ ЧАСІ Мета: ознайомити учнів з поняттям “швидкість руху”, скороченим позначенням швидкості при числах, простими і складеними задачами на знаходження швидкості; розвивати навички усних та письмових обчислень; виховувати інтерес до предмета. ХІД УРОКУ I. ОРГАНІЗАЦІЙНИЙ МОМЕНТ II. КОНТРОЛЬ, КОРЕКЦІЯ І ЗАКРІПЛЕННЯ ЗНАНЬ 1. Перевірка домашнього завдання 2. Усні обчислення Гра “Ланцюжок” – Запишіть відповіді в порядку зростання […]...
- Ентропія реакції – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.3. Ентропія реакції У кожній реакції впорядкований стан системи змінюється і, отже, змінюється ентропія. Зміна ентропії реакції ∆SR, як і ентальпії реакції, визначається як різниця суми ентропій продуктів реакції і суми ентропій початкових речовин: Приклад. Під час реакції газоподібного гідроген хлориду з газоподібним амоніаком з двох “невпорядкованих” […]...
- Реакції в гетерогенному і гомогенному середовищі ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ Більшість хімічних реакцій “миттєво” не відбуваються. Для реакції між початковими речовинами й утворенням продуктів потрібний певний час, який може бути дуже коротким. Запам’ятайте: реакції між Іонами відбуваються, як правило, набагато швидше, ніж реакції між молекулами. 1. Реакції в гетерогенному і гомогенному середовищі Реакції можуть відбуватися між речовинами в гетерогенному середовищі (наприклад, суміші […]...
- ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ Швидкість і механізм хімічної реакції вивчає хімічна кінетика. Швидкість хімічної реакції характеризується зміною концентрації однієї з вихідних речовин або кінцевих продуктів за одиницю часу. Середня швидкість реакції: Де с1 і с2 – початкова і кінцева концентрація речовини; τ1 і […]...
- Стан рівноваги – Константа рівноваги – Характеристики хімічної рівноваги ХІМІЧНА РІВНОВАГА 1. Характеристики хімічної рівноваги 1.2 . Константа рівноваги У ході реакції рівноваги первинна концентрація початкових речовин постійно зменшується. Внаслідок цього знижується і швидкість прямої реакції. Одночасно постійно підвищується концентрація продуктів реакції. Внаслідок цього підвищується швидкість зворотної реакції. Для бімолекулярної реакції типу можна скласти наступні вирази швидкості прямої та зворотної реакції: Коли швидкості обох […]...
- Ентальпія реакції – Перетворення енергії в хімічних реакціях ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 1 . Перетворення енергії в хімічних реакціях 1.3 . Ентальпія реакції Енергію, що виділилася або була поглинута в ході хімічної реакції, називають ентальпією реакції ∆HR або тепловим ефектом реакції. Значення цієї енергії легко визначити, якщо відомі ентальпії утворення ∆Hf відповідних речовин, що беруть участь у реакції. Тепловим ефектом реакції є різниця енергії […]...
- Рівняння окисно-відновної реакції – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції 1.3. Рівняння окисно-відновної реакції Дуже часто важко скласти рівняння окисно-відновної реакції, якщо невідомо, як саме реагують речовини одна з одною. Використовуючи ступінь окиснення елементів, цю проблему можна вирішити. Перед складанням рівняння окисно-відновної реакції потрібно знати наступне: – який продукт окиснення і продукт відновлення утворюється; – чи проходить реакція в […]...
- Хімічна рівновага – Хімічні реакції Хімія Загальна хімія Хімічні реакції Хімічна рівновага Хімічні реакції, які за одних і тих самих умов можуть іти в протилежних напрямах, називаються оборотнимИ. У випадку, якщо за даних умов реагенти повністю перетворюються на продукти реакції, реакції називаються НеоборотнимИ. Умови необоротності хімічних реакцій 1) Продукти, що утворюються, виводяться зі сфери реакції – випадають у вигляді осаду, […]...
- Швидкість хімічної реакції – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач І. Швидкість хімічної реакції Формули і поняття, які використовуються: Де v1 – швидкість прямої реакції, V2 – швидкість зворотної реакції, A, Б – реагенти реакції, B, Г – продукти реакції, С(А), с(Б) – концентрації реагентів, С(В), […]...
- Ступінь окиснення – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції 1.2. Ступінь окиснення Водень і хлор реагують під час яскраво вираженої екзотермічної реакції, перетворюючись на гідроген хлорид: Н2 + Сl2 → 2НСl. Ця реакція також окисно-відновна, хоча в цьому випадку, власне, переходу електронів не відбувається. У молекулі гідроген хлориду атом Гідрогену зв’язаний з атомом Хлору спільною парою електронів. Щоб […]...
- Космічні швидкості – Динаміка 5. Механіка 5.2. Динаміка 5.2.19. Космічні швидкості Космічні швидкості – мінімальні швидкості космічного апарата, за яких він може: 1) стати супутником планети – перша космічна швидкість. Для супутників Землі: Де R – радіус Землі, або , де M – маса Землі; r – відстань від центра Землі до точки простору, де тіло набуває першої космічної […]...
- ПОРЯДОК КОНСУМЕНТА Екологія – охорона природи ПОРЯДОК КОНСУМЕНТА – місце консумента в екол. піраміді. Розрізняють консументів першого порядку, що живляться рослинами-продуцентами (рослиноїдні), консументів другого порядку, що живляться рослиноїдними організмами (хижаки), та консументів третього порядку, об’єктами живлення яких є слабші хижаки. Ін. ряд консументів йде по лінії паразитів – паразит травоїдного організму, або хижак, надпаразит цього паразита, надпаразит […]...
- Радикальна полімеризація – Радикальні реакції ОРГАНІЧНІ РЕАКЦІЇ 2. Радикальні реакції 2.2. Радикальна полімеризація Полімеризація – це реакція, в якій дуже багато молекул низькомолекулярних речовин – мономерів, – з’єднуються один з одним у довгі ланцюги – полімери. Реакція починається за участю стартера (ініціатора) – активної молекули, яка розпадається під дією світла на радикали. Ці радикали можуть “атакувати” подвійні зв’язки, причому щоразу […]...
- Аналіз контрольної роботи. Текст, його головна думка, заголовок. Порядок виконання звуко-буквеного аналізу слова. Порядок розбору слів за будовою Урок 113 Тема. Аналіз контрольної роботи. Текст, його головна думка, заголовок. Порядок виконання звуко-буквеного аналізу слова. Порядок розбору слів за будовою Мета: повторити й закріпити в учнів поняття про текст як зв’язне висловлення певної думки, повторити порядок звуко-буквеного аналізу слова і порядок розбору слів за будовою; розвивати вміння підбирати заголовок до тексту, який би виражав […]...
- РЕАКЦІЇ ОБМІНУ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ ОБМІНУ Реакції між складними хімічними речовинами, в результаті яких відбувається обмін між ними окремими атомами або групами атомів, називаються реакціями обміну. Наприклад: Реакції обміну (крім сильно екзотермічної реакції нейтралізації) зазвичай супроводжуються невеликим тепловим ефектом, тобто відбувається лише невелика зміна внутрішньої енергії системи, і вона не може бути […]...
- Швидкість хімічної реакції. Каталізатор – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.8. Швидкість хімічної реакції. Каталізатор Розділ хімії, що вивчає швидкість хімічних реакцій, називають хімічною кінетикою. Розгляньмо зміст деяких понять, які використовують у цьому розділі. Швидкість хімічних реакцій характеризується зміною концентрації реагентів (або продуктів реакції) за одиницю часу. Якщо реакції відбуваються […]...
- Зворотність реакції – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.5 . Зворотність реакції Відповідно до рівняння Гіббса-Гельмгольца, вільна енергія реакції ∆G0R залежить від температури. Якщо не враховувати залежність температури від ∆H0R і ∆S0R, то рівняння Гіббса-Гельмгольца відповідає рівнянню прямої. Залежно від знаків ∆H0R і ∆S0R розрізняють чотири типи реакції. Тип 1: при температурі Т < Т0 […]...
- Тепловий ефект реакції. Екзотермічні й ендотермічні реакції. Термохімічні рівняння Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 24 Тема уроку. Тепловий ефект реакції. Екзотермічні й ендотермічні реакції. Термохімічні рівняння Цілі уроку: розширити уявлення про хімічні реакції на прикладі ендотермічних і екзотермічних реакцій; ознайомити учнів з поняттями “тепловий ефект хімічної реакції”, “термохімічні рівняння”; формувати навички й уміння складати термохімічні рівняння реакцій, розв’язувати задачі з їх використанням. Тип уроку: […]...
- Реакції іонного обміну – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.11. Реакції іонного обміну Згідно з теорією електролітичної дисоціації всі реакції у водних розчинах електролітів є реакціями між іонами. Вони називаються іонними реакціями, а рівняння цих реакцій – іонними рівняннями. Вони простіші, ніж рівняння реакцій, […]...
- Вільна енергія реакції Гіббса – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.4. Вільна енергія реакції Гіббса Кожна реакція характеризується двома тенденціями: – система речовин прагне перейти у стан з якомога меншою ентальпією; – система речовин прагне перейти в стан з якомога більшою ентропією. Тому реакція Проходить самочинно в той бік, де знижується ентальпія реакції і зростає її ентропія. […]...
- ОКИСНО-ВІДНОВНІ РЕАКЦІЇ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ ОКИСНО-ВІДНОВНІ РЕАКЦІЇ Окисно-відновні реакції проходять за рахунок переходу електронів або атомів від одних частинок до інших. У реакції Відбувається перехід електронів від атомів заліза (відновник) до іонів Купруму (окисник). В реакції Відбувається перехід атомів Оксигену від іонів СlO – (окисник) до йонів SO32- […]...
- Механізм утворення естерів – Реакції естерифікації ОРГАНІЧНІ РЕАКЦІЇ 4. Реакції естерифікації Реакцію обміну спиртів з карбоновими кислотами називають реакцією естерифікації, при відщеплюванні води утворюються естери. Приклад. Із метанової (мурашиної) кислоти і метанолу утворюється метиловий естер метанової кислоти: Естерифікація оборотна (омилення) і веде до встановлення рівноваги між початковими речовинами і продуктами реакції. Механізм утворення естерів Оскільки дана реакція оборотна, то й усі […]...
- Прямий та зворотний порядок слів у реченні – Речення Словосполучення Речення Прямий та зворотний порядок слів у реченні При прямому (звичайному) порядку слів у реченні спочатку йде підмет, потім – присудок; означення, потім – означуване слово; додаток стоїть після слова, яке ним керує, а обставина – перед присудком. Якщо такий порядок порушується, особливо коли підмет стоїть після присудка, а означуване слово перед означенням, то […]...