Процеси окиснення, відновлення. Окисники, відновники
Тема 2
ХІМІЧНІ РЕАКЦІЇ
Урок 26
Тема уроку. Процеси окиснення, відновлення. Окисники, відновники
Цілі уроку: розширити уявлення про хімічні реакції на прикладі реакцій окиснення й відновлення; сформувати знання про процеси окиснення й відновлення; показати єдність двох протилежних процесів: окиснення й відновлення – як властивості атомів віддавати та приєднувати електрони; ознайомити учнів із прикладами окисників і відновників.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на
Форми роботи: фронтальна робота, виконання тренувальних вправ, самостійна робота, розповідь учителя.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання.
Актуалізація опорних знань
1. Перевірка домашнього завдання, обговорення відповідей учнів
2. Фронтальна робота
– Що таке ступінь окиснення?
– Які правила необхідно згадати, щоб визначити ступінь окиснення атомів у речовині?
– Розрахуйте ступінь окиснення Нітрогену в сполуках: NH3, NO,
– Запишіть процеси передачі електронів, у результаті яких ступінь окиснення Нітрогену зміниться від 0 до -3; +3; +4.
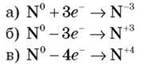
– Подумайте, у яких випадках ідеться про процеси окиснення. (б, в)
– Подумайте, у яких випадках ідеться про процеси відновлення. (а)
ІІІ. Засвоєння нових знань, умінь і навичок
Окиснення, відновлення
Окиснення – це процес віддачі електронів атомами (ступінь окиснення збільшується).
Відновлення – це процес приєднання електронів атомами (ступінь окиснення зменшується).
При цьому слід пам’ятати, що ці два процеси взаємно доповнюють один одного і протікають одночасно, тому реакції зі зміною ступеня окиснення називаються окисно-відновними (ОВР).
Розглянемо на простому прикладі:
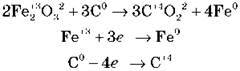
Ступінь окиснення Феруму змінився від +3 до 0, тобто відбулося відновлення заліза з ферум(ІІІ) оксиду, але паралельно протікає процес окиснення Карбону від ступеня окиснення 0 до +4.
У цьому випадку C0 – відновник, а Fe2O3 – окисник.
IV. Застосування одержаних знань (практика на прикладах)
Завдання 1. Допишіть рівняння, укажіть процеси окиснення й відновлення. Укажіть окисник і відновник.
(Учні біля дошки по ланцюжку виконують завдання, увесь клас працює в зошитах і звіряє відповіді з дошкою.)
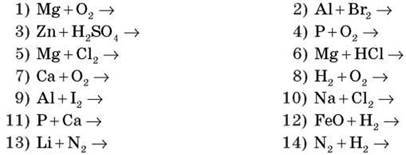
Додаткове завдання. Укажіть тип хімічної реакції.
Завдання 2. Сульфур може проявляти ступені окиснення -2, +4, +6. Наведіть приклади сполук Сульфуру й укажіть, окисні чи відновні властивості вони мають.
Самостійна робота (під керівництвом учителя, з обговоренням результатів у класі)
Завдання. Допишіть ОВР, укажіть окисник і відновник, процеси відновлення й окиснення.
Варіант І
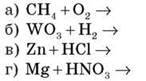
Варіант ІІ
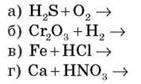
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Творче завдання. Згадайте й наведіть приклади ОВР, з якими ми ознайомилися в курсах природознавства й хімії 7, 8 класу.
