Прості речовини – КАРБОН. СИЛІЦІЙ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЯ ЕЛЕМЕНТІВ
КАРБОН. СИЛІЦІЙ
Прості речовини
Фізичні властивості простих речовин
Властивості | Графіт | Алмаз | Карбін | Кремній |
Формула сполуки | C_ | C_ | C_ | Si |
Зовнішній вигляд у звичайних умовах | Сірий, має металічний блиск | Блискучі прозорі кристали, | Чорна тверда речовина | Темно-сіра речовина з металічним блиском |
Температура плавлення | +3700 °С – сублімується з розкладом | +1200 °С – перехід у графіт | +2000 °С – перехід у графіт | + 1415 °С |
Температура кипіння | – | – | – | +2620 °С |
Густина при н. у. | 2,3 г/см3 | 3,5 г/см3 | 2 г/см3 | 2,3 г/см3 |
Розчинність у воді | Нерозчинний | Нерозчинний | Нерозчинний | Нерозчинний |
Електрична | 0,1 від електропровідності ртуті | Діелектрик | Напівпровідник n-типу | 0,001 від електропровідності ртуті; напівпровідник |
Твердість (за шкалою Мооса) | 2 (уздовж шарів), 5 (упоперек). Досить м’який | Найтвердіший мінерал | Нетвердий | Досить твердий |
Теплопровідність | Провідність теплоти в 3 рази краща, ніж у ртуті | Гарний провідник теплоти | Теплоту проводить погано | Гарний провідник теплоти |
Будова кристалічної гратки алмазу
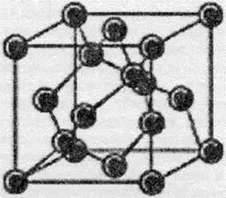
Як видно з малюнка, усі атоми Карбону в алмазі зв’язані з чотирма сусідніми атомами. За рахунок дуже щільної упаковки атомів у кристалі, алмаз має дуже високу твердість та густину. Попри те, що алмаз і є найтвердішою природною речовиною, він має високу крихкість, і тому огранювання алмазів не складає жодних труднощів. Атоми Карбону в алмазі перебувають у sр3-гібридному стані.
Кристалічна будова графіту
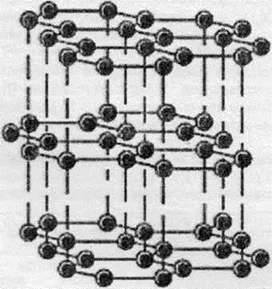
У графіті атоми Карбону з’єднані в шари. Шари складаються з правильних шестикутників. Відстань між шарами у 2,36 рази більша від одинарного С-С зв’язку в шарі, тому сусідні шари не мають міцного зв’язку один з одним. Саме тому графітні стрижні можна застосовувати для письма, оскільки при терті грифелем олівця об папір послідовно стираються шар за шаром, залишаючи на папері сірий слід. Атоми Карбону в графіті перебувають в sр2-гібридному стані, що забезпечує плоску структуру шару. Три електрони утворюють три зв’язки із сусідніми атомами в шарі, а четвертий електрон може виконувати дві функції: забезпечувати зв’язок між шарами або забезпечувати електронну провідність.
Молекули карбіну являють собою лінійні ланцюги, що складаються з атомів Карбону, зв’язаних подвійними зв’язками (полікумулен) або навперемінними одинарними та потрійними зв’язками (карбін).
Крім того, виділяють таку алотропну форму, як “аморфний” вуглець. Насправді він являє собою маленькі (від 10 до 300 атомів) фрагменти графіту, хаотично об’єднані в одну неплоску несиметричну структуру. Залежно від методу добування та деяких фізичних властивостей, виділяють кілька типів аморфного вуглецю: деревне вугілля, тваринне вугілля та сажу.
Окрім наведених модифікацій Карбону, існують іще так звані фулерени, чиї молекули мають кулясту форму:

Фулерени являють собою темні порошки, які сублімуються при температурі понад +350 °С і проявляють властивості напівпровідника.
За певних умов можуть утворюватися так звані “нанотрубки” або “тубулени”, які являють собою порожнисту вуглецеву трубку, з обох кінців закриту кришками, схожими на фрагменти шматків фулерена. Розміри однієї молекули нанотрубки досить великі: довжина від 20 до 50 нм, а діаметр від 0,9 до 12 нм (1 нм = 10-9 м).
