Протолітична теорія кислот і основ – РОЗЧИНИ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
§ 5.13. Протолітична теорія кислот і основ
Теорія електролітичної дисоціації пояснила численні явища і процеси, що відбуваються у водних розчинах електролітів. Так, наприклад, у різних реакціях нейтралізації
NaOH + НСl = NaCl + Н2O;
КОН + HNO3 = KNO3 + Н2O
Одне і те саме значення теплового ефекту (57,3 кДж/моль) пояснюється утворенням малодисоційованих молекул води з Н+ – і ОН – – іонів:
Н+
При змішуванні розчинів NaCl і KNO3
Na+ + С – + К+ + NO3- = Na+ + NO3- + К+ + Сl-
Тепловий ефект не спостерігається. Це пояснюється тим, що хімічна взаємодія між іонами Na+ , Сl-, К+ , NO3- не відбувається, як це випливає з іонного рівняння.
Електролітична дисоціація стала основою успішного розвитку теорії розчинів і вивчення процесів, що відбуваються в них. У цьому полягає її велике значення в хімії. Ця теорія не пояснює процесів, що відбуваються в неводних розчинах. Так, наприклад, якщо хлорид амонію у водному розчині поводить себе як сіль (дисоціює на іони NH4 і Сl-), то в рідкому аміаку він виявляє властивості кислоти
Згідно з цією теорією кислотами є речовини, молекули або іони, що відщеплюють під час перебігу даної реакції протони. Основами є речовини, молекули або іони, що приєднують протони. Як одні, так й інші дістали загальну назву протолітів.
Реакція відщеплення протона зображується рівнянням
Кислота ⇆ Основа + Н+.
Кислота й основа такого процесу називаються спряженими. Це не кислотно-основна пара. Наприклад, іон Н3О – кислота, спряжена основі Н2О, а хлорид-іон Сl – – основа, спряжена кислоті НСl.
Вільні протони в розчинах самостійно не існують. Вони переходять від кислоти до якої-небудь основи. Тому в розчині завжди відбуваються два процеси:
Кислота1 ⇆ Основа1 + Н+;
Основа2 + Н+ ⇆ Кислота2
I рівновагу між ними зображують рівнянням
Кислота1 + Основа2 ⇆ Основа1 + Кислота2.
Наприклад, реакцію нейтралізації ацетатної кислоти аміаком можна зобразити так:
СН3СООН ⇆ СН3СОО – + Н+;
NH3 + H+ ⇆ NH4+;
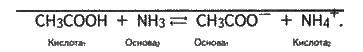
Тут ацетатна кислота є кислотою (віддає протони Н+), аміак – основою (приєднує протони), іони СН3СОО – відіграють роль основи (в цьому оборотному процесі вони можуть прийняти протони і перетворитися знову в ацетатну кислоту), а іони амонію відіграють роль кислоти (можуть віддати протони).
Аналогічно можна зобразити виявлення основних властивостей нітратної кислоти, розчиненої в рідкому фтороводні:
NF + HNO3 ⇆ F – + +.
Кислотаї Основаг Основаї Кислотаг
Отже, з кислоти й основи завжди утворюються нові спряжені кислота й основа. Протолітична теорія розглядає реакцію нейтралізації як перехід протона кислоти до основи. Як бачимо, протолітична теорія розширила коло кислот і основ порівняно з уявленнями теорії електролітичної дисоціації: ними можуть бути також іони. Одна й та сама речовина залежно від того, з чим вона реагує, може бути або кислотою, або основою. Теорія розкрила відносність понять про кислоти й основи і показала, що продукти їх взаємодії слід розглядати як нові кислоти й основи. Протолітична теорія є сучасною й загальнішою теорією кислот і основ.
