Реакції іонного обміну – РОЗЧИНИ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
§ 5.11. Реакції іонного обміну
Згідно з теорією електролітичної дисоціації всі реакції у водних розчинах електролітів є реакціями між іонами. Вони називаються іонними реакціями, а рівняння цих реакцій – іонними рівняннями. Вони простіші, ніж рівняння реакцій, записаних у молекулярній формі, і мають загальніший характер.
При складанні іонних рівнянь реакцій слід керуватися тим, що речовини
Щоб закріпити ці положення, розглянемо два приклади.
Приклад 1. Напишіть рівняння реакцій між розчинами хлориду феруму(III) й гідроксиду натрію
Розіб’ємо розв’язання задачі на чотири етапи.
1. Запишемо рівняння реакції в молекулярній формі:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl.
2. Перепишемо це рівняння, зобразивши речовини, що добре дисоціюють, у вигляді іонів, а ті, що виходять зі сфери реакції, – у вигляді молекул:
Fe3+ + 3Сl – + 3Na+ + ЗОН – = Fe(OH)3↓+ 3Na+ + 3Cl – . Це іонне рівняння реакції.
3. Виключимо з обох частин іонного рівняння однакові іони, тобто іони, які не беруть участі в реакції (вони підкреслені):
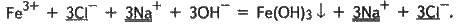
4. Запишемо рівняння реакції в остаточному вигляді:
Fe3+ + ЗОН – = Fe(OH)3 ↓.
Це скорочене іонне рівняння реакції. Як виднoз цього рівняння, суть реакції зводиться до взаємодії іонів Fe3+ і ОН – , внаслідок чого утворюється осад Fe(OH)3. При цьому зовсім не має значення, до складу яких електролітів входили ці іони до їх взаємодії.
Приклад 2. Напишіть рівняння реакцій між розчинами хлориду калію і нітрату натрію.
Оскільки продукти взаємодії добре розчинні у воді і не виходять зі сфери реакції, то дана реакція оборотна.
Як і в прикладі 1, записуємо за етапами:
1. КСl + NaNO3 ⇆ KNO3 + NaCl.
2. К+ + Сl – + Na+ + N)3- ⇆ К+ + N)3- + Na+ + Сl-.
Рівняння для наступних етапів написати не можна, оскільки з погляду теорії електролітичної дисоціації реакція не відбувається. Однак якщо випарювати цей розчин, то виникатимуть нові хімічні зв’язки між іонами й утвориться суміш чотирьох солей: КСl, NaNO3, NaCl, KNO3.
Іонними рівняннями можна зображувати будь-які реакції, що відбуваються в розчинах між електролітами. Якщо під час таких реакцій заряди іонів не змінюються (не змінюється ступінь окиснення), то вони називаються іонообмінними.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Реакції обміну між розчинами електролітів, умови їх протікання Тема 1 РОЗЧИНИ УРОК 14 Тема уроку. Реакції обміну між розчинами електролітів, умови їх протікання Цілі уроку: показати процеси, що протікають у розчинах електролітів як реакції обміну між іонами; ознайомити з умовами їх протікання; формувати навички складання іонних рівнянь. Тип уроку: формування вмінь і навичок та їх творчого застосування. Форми роботи: розповідь учителя, демонстраційний експеримент, […]...
- РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ У розчинах електролітів у хімічну взаємодію вступають іони. З’ясуємо, у яких випадках це відбувається. Якщо змішати водні розчини кухонної солі (хлориду натрію) і вапняної води (розчину гідроксиду кальцію), то зовнішніх змін не спостерігається. Формально можна написати З огляду на те, що всі чотири речовини (хлорид і […]...
- Теорія електролітичної дисоціації – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.5. Теорія електролітичної дисоціації Для пояснення особливостей водних розчинів електролітів шведський учений С. Арреніус у 1887 р. запропонував теорію електролітичної дисоціації. Пізніше вона була розвинута багатьма вченими на основі вчення про будову атомів і хімічний […]...
- РЕАКЦІЇ ОБМІНУ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ ОБМІНУ Реакції між складними хімічними речовинами, в результаті яких відбувається обмін між ними окремими атомами або групами атомів, називаються реакціями обміну. Наприклад: Реакції обміну (крім сильно екзотермічної реакції нейтралізації) зазвичай супроводжуються невеликим тепловим ефектом, тобто відбувається лише невелика зміна внутрішньої енергії системи, і вона не може бути […]...
- Реакції сполучення, розкладу, заміщення й обміну Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 22 Тема уроку. Реакції сполучення, розкладу, заміщення й обміну Цілі уроку: розвивати навички й уміння складати рівняння хімічних реакцій; формувати навички розпізнавання типів реакцій теоретично – за рівняннями реакції, експериментально – за ознаками хімічних реакцій. Тип уроку: формування вмінь і навичок. Форми роботи: фронтальне опитування, демонстраційний експеримент, групова робота, самостійна […]...
- Практична робота № 2. Реакції іонного обміну в розчинах електролітів Тема 1 РОЗЧИНИ Урок 16 Тема уроку. Практична робота № 2. Реакції іонного обміну в розчинах електролітів Цілі уроку: перевірити вміння використовувати практичні знання про електролітичну дисоціацію, навички дослідження розчинів, складання іонних рівнянь; уміння спостерігати, робити висновки. Тип уроку: практичного застосування знань, умінь і навичок. Форми роботи: самостійна практична робота. Обладнання: таблиця розчинності, набір хімічних […]...
- Електролітична дисоціація – Розчини Хімія Загальна хімія Розчини Електролітична дисоціація Речовини, розчини або розплави яких проводять електричний струм, називаються електролітамИ. Речовини, розчини або розплави яких не проводять електричного струму, називаються неелектролітамИ. Розпад електролітів на йони під час їхнього розчинення у воді називається електролітичною дисоціацієЮ. Основні положення теорії електролітичної дисоціації 1) Електроліти під час розчинення у воді розпадаються (дисоціюють) на […]...
- Механізм дисоціації – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.6. Механізм дисоціації Суттєвим є питання про механізм електролітичної дисоціації. І дійсно, чому електроліти дисоціюють на іони? Вчення про хімічний зв’язок атомів допомагає відповісти на це запитання. Найлегше дисоціюють речовини з іонним зв’язком. Як відомо, […]...
- Ступінь дисоціації – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.9. Ступінь дисоціації Оскільки електролітична дисоціація – процес оборотний, то в розчинах електролітів поряд з їх іонами є й молекули. Тому розчини електролітів характеризуються ступенем дисоціації (позначається грецькою буквою “альфа” а). Ступінь дисоціації – це […]...
- Теорія електролітичної дисоціації. Іонні реакції I СЕМЕСТР ПОВТОРЕННЯ ОСНОВНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ (4 год.) УРОК 3 Тема уроку. Теорія електролітичної дисоціації. Іонні реакції Цілі уроку: актуалізувати знання учнів про процеси, що протікають у розчинах; узагальнити знання про електролітичну дисоціацію речовин; удосконалювати вміння й навички складання повних і скорочених іонно-молекулярних рівнянь реакцій. Тип уроку: повторення й систематизації знань. Форми […]...
- ОБОРОТНІ РЕАКЦІЇ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ ОБОРОТНІ РЕАКЦІЇ Реакція дисоціації води, рівняння якої наведено у попередньому параграфі, протікає незначною мірою. З кожного мільярда молекул води в ній беруть участь лише дві, тому концентрація кожного з іонів, які утворюються, мізерно мала (10-7 моль/л). Коли кажуть, що вода – слабкий електроліт, то мають на увазі, що вона слабко […]...
- Розв’язування типових задач Масова частка розчиненої речовини – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.14. Розв’язування типових задач Масова частка розчиненої речовини Задача 1. Потрібно приготувати розчин масою 320 г з масовою часткою хлориду калію 3%. Розрахуйте масу КСl і масу води, які необхідні для приготування розчину. Розв’язання. Обчислюємо […]...
- Електроліти і неелектроліти – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.4. Електроліти і неелектроліти Добре відомо, що одні речовини в розчиненому або розплавленому вигляді проводять електричний струм, інші за таких самих умов струм не проводять. Це можна простежити за допомогою простого приладу (рис. 5.4). Він […]...
- Сильні й слабкі електроліти – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.10. Сильні й слабкі електроліти Розрізняють сильні й слабкі електроліти. Сильні електроліти під час розчинення у воді повністю дисоціюють на іони. До них належать: 1) майже всі солі; 2) багато мінеральних кислот, наприклад H2SO4, HNO3, […]...
- Гідратація іонів – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.7. Гідратація іонів Відомий російський хімік І. О. Каблуков довів, що електролітичну дисоціацію не можна пояснити без хімічної теорії розчинів Д. І. Менделєєва. Як відомо, Д. І. Менделєєв експериментально обгрунтував утворення хімічних сполук під час […]...
- РЕАКЦІЇ РОЗКЛАДУ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ РОЗКЛАДУ З назви “реакція розкладу” також випливає, про який тип реакцій іде мова. У реакції розкладу відбувається розкладання складної речовини на декілька речовин. Продуктами реакції можуть бути як прості, так і складні речовини. Наприклад: Майже всі вказані реакції, як і переважна більшість інших реакцій розкладу, ендотермічні. Для […]...
- Порядок реакції – Вираження швидкості реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 3. Вираження швидкості реакції 3.2 . Порядок реакції На основі теорії зіткнення для різних типів молекулярних реакцій можна записати вирази для швидкості реакції: Константа k – константа швидкості реакції. Через спільний вплив різних чинників на швидкість реакції результати експериментів часто не відповідають теоретичним припущенням. Тому певна реакція описується експериментально виведеним рівнянням (виразом) […]...
- Молекулярність реакції – Вираження швидкості реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 3. Вираження швидкості реакції Згідно з теорією зіткнення, збільшення вдвічі кількості частинок реагенту в певному об’ємі веде до збільшення кількості зіткнень вдвічі і, відповідно, до збільшення швидкості реакції вдвічі. При збільшенні втричі концентрації частинок відбувається збільшення швидкості реакції втричі і т. д. 3.1 . Молекулярність реакції Реакції, в яких від початкових речовин […]...
- Дія буферів – Буферні розчини – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.5. Буферні розчини Дія буферів Використовуючи константу рівноваги процесу дисоціації кислоти, можна показати дію буфера: – Додавання кислоти, тобто збільшення с(Н3О+). Для збереження рівноваги додані іони гідроксонію реагуватимуть з відповідними іонами А-, утворюючи недисоційовану НА, практично не змінюючи концентрацію іонів гідроксонію. – Додавання лугу, тобто збільшення с(ОН-). Додані гідроксид-іони […]...
- Швидкість хімічної реакції – Хімічні реакції Хімія Загальна хімія Хімічні реакції Швидкість хімічної реакції Швидкість хімічної реакції Визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму. Формула середньої швидкості хімічної реакції: де – середня швидкість хімічної реакції, – зміна концентрації реагенту, – час. Чинники, що впливають на швидкість хімічної реакції 1) Природа реагуючих речовин. 2) Агрегатний стан реагуючих речовин. […]...
- Протолітична теорія кислот і основ – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.13. Протолітична теорія кислот і основ Теорія електролітичної дисоціації пояснила численні явища і процеси, що відбуваються у водних розчинах електролітів. Так, наприклад, у різних реакціях нейтралізації NaOH + НСl = NaCl + Н2O; КОН + […]...
- Реакції в розчинах електролітів. Складання молекулярних і йонно-молекулярних рівнянь ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.10. Реакції в розчинах електролітів. Складання молекулярних і йонно-молекулярних рівнянь За нормальних умов тверді речовини зазвичай не вступають між собою в хімічні реакції. Хоч би один з реагентів повинен бути в газоподібному чи рідкому (розчиненому) стані. Отже, у хімії […]...
- РЕАКЦІЇ ЗАМІЩЕННЯ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ ЗАМІЩЕННЯ Реакції між простою і складною речовиною, в результаті яких атоми простої речовини заміщають атоми одного з елементів складної речовини, називаються реакціями заміщення. Наприклад: Рушійною силою реакцій заміщення є утворення більш міцних сполук. З хімічної точки зору чим активніший хімічний елемент, тим міцніші сполуки він утворює, і […]...
- Рівняння окисно-відновної реакції – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції 1.3. Рівняння окисно-відновної реакції Дуже часто важко скласти рівняння окисно-відновної реакції, якщо невідомо, як саме реагують речовини одна з одною. Використовуючи ступінь окиснення елементів, цю проблему можна вирішити. Перед складанням рівняння окисно-відновної реакції потрібно знати наступне: – який продукт окиснення і продукт відновлення утворюється; – чи проходить реакція в […]...
- Дисоціація води – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.12. Дисоціація води. pH Водa і як слабкий електроліт незначною мірою дисоціює на іони Н+ і ОН-, що перебувають у рівновазі з недисоційованими молекулами: Н2O ⇆ Н+ + ОН-. Концентрацію іонів звичайно виражають у молях […]...
- Необоротні й оборотні реакції ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.5. Необоротні й оборотні реакції Реакції, які відбуваються тільки в одному напрямку і завершуються повним перетворенням вихідних реагуючих речовин у кінцеві речовини, називаються необоротними. Прикладом такої реакції може бути розклад хлорату калію (бертолетової солі) під час […]...
- Опис швидкості реакції – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.3 . Опис швидкості реакції Швидкість реакції можна описати як зміну концентрації початкової речовини і як зміну продукту реакції за певний проміжок часу. І в одному і в іншому випадку за певний проміжок часу вона визначається за кутом нахилу січної відповідного графіка с(t). В один і той самий проміжок […]...
- Швидкість хімічної реакції – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Швидкість хімічної реакції Хімічні реакції відрізняються одна від одної тривалістю їхнього протікання. Деякі хімічні реакції відбуваються миттєво (наприклад, вибух воднево-кисневої суміші, реакції обміну з утворенням осаду), інші – досить швидко (горіння речовин), треті – повільно (більшість реакцій […]...
- Електроліз водних розчинів електролітів – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.7. Електроліз водних розчинів електролітів Слід розрізняти електроліз розплавлених електролітів і їх розчинів. В останньому випадку в процесах можуть брати участь молекули води. Як приклад розглянемо електроліз концентрованого водного розчину хлориду натрію (електроди вугільні). В цьому […]...
- Дисоціація кислот, основ і солей у водних розчинах – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.8. Дисоціація кислот, основ і солей у водних розчинах За допомогою теорії електролітичної дисоціації дають означення й описують властивості кислот, основ і солей. Кислотами називаються електроліти, під час дисоціації яких як катіони утворюються тільки катіони […]...
- Хімічна рівновага – Хімічні реакції Хімія Загальна хімія Хімічні реакції Хімічна рівновага Хімічні реакції, які за одних і тих самих умов можуть іти в протилежних напрямах, називаються оборотнимИ. У випадку, якщо за даних умов реагенти повністю перетворюються на продукти реакції, реакції називаються НеоборотнимИ. Умови необоротності хімічних реакцій 1) Продукти, що утворюються, виводяться зі сфери реакції – випадають у вигляді осаду, […]...
- Тепловий ефект реакції. Екзотермічні й ендотермічні реакції. Термохімічні рівняння Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 24 Тема уроку. Тепловий ефект реакції. Екзотермічні й ендотермічні реакції. Термохімічні рівняння Цілі уроку: розширити уявлення про хімічні реакції на прикладі ендотермічних і екзотермічних реакцій; ознайомити учнів з поняттями “тепловий ефект хімічної реакції”, “термохімічні рівняння”; формувати навички й уміння складати термохімічні рівняння реакцій, розв’язувати задачі з їх використанням. Тип уроку: […]...
- ТЕПЛОВИЙ ЕФЕКТ ХІМІЧНОЇ РЕАКЦІЇ – КИСЕНЬ Хімія – універсальний довідник КИСЕНЬ ТЕПЛОВИЙ ЕФЕКТ ХІМІЧНОЇ РЕАКЦІЇ Реакції, що супроводжуються виділенням теплоти, називаються екзотермічними. Наприклад, Реакції, що супроводжуються поглинанням теплоти, називаються ендотермічними. Наприклад, Кількість теплоти, що виділяється або поглинається в реакції, називається тепловим ефектом реакції. Тепловий ефект реакції ΔН – це різниця між вмістом енергії у вихідних речовинах і кінцевих продуктах реакції. Тепловий […]...
- Визначення – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції У ході хімічної реакції кількість початкових речовин постійно зменшується, а кількість продуктів реакції відповідно збільшується. Зміну кількості початкових речовин чи продуктів реакції за певний проміжок часу називають швидкістю реакції. 2.1. Визначення Швидкість реакції v визначається як зміна кількості п речовини за певний проміжок часу: ∆n – зміна кількості речовини […]...
- ОКИСНО-ВІДНОВНІ РЕАКЦІЇ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ ОКИСНО-ВІДНОВНІ РЕАКЦІЇ Окисно-відновні реакції проходять за рахунок переходу електронів або атомів від одних частинок до інших. У реакції Відбувається перехід електронів від атомів заліза (відновник) до іонів Купруму (окисник). В реакції Відбувається перехід атомів Оксигену від іонів СlO – (окисник) до йонів SO32- […]...
- РІВНЯННЯ ХІМІЧНОЇ РЕАКЦІЇ Хімія – універсальний довідник КІЛЬКІСНІ ВІДНОШЕННЯ В ХІМІЇ РІВНЯННЯ ХІМІЧНОЇ РЕАКЦІЇ Хімічний процес як перетворення одних речовин в інші описується за допомогою рівняння хімічної реакції. При складанні рівняння варто враховувати, що число атомів кожного елемента зліва і справа повинно бути однаковим (адже в рівнянні вказано знак рівності), тому перед формулами речовин-реагентів і речовин-продуктів ставляться числові […]...
- Хімічні реакції. Схеми реакцій, хімічні рівняння – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.1. Хімічні реакції. Схеми реакцій, хімічні рівняння Хімічними реакціями називають перетворення однієї чи декількох речовин, які відрізняються одна від одної складом чи будовою молекули, на інші. Речовини, які вступають у хімічні реакції, називають вихідними речовинами, або реагентами, а речовини, які […]...
- РЕАКЦІЇ СПОЛУЧЕННЯ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ СПОЛУЧЕННЯ Уже сама назва “реакція сполучення” говорить про її тип. У результаті сполучення декількох речовин утворюється одна нова речовина. Практично завжди в реакцію сполучення вступає не більше двох речовин; ці речовини можуть бути як простими, так і складними. Приклади реакцій сполучення: У переважній більшості реакції сполучення є […]...
- Теорія окисно-відновних реакцій – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.1. Теорія окисно-відновних реакцій Усі хімічні реакції можна розділити на два типи. До першого належать реакції, які відбуваються без зміни ступеня окиснення атомів, що входять до складу реагуючих речовин. Наприклад: +1 +5 -2 +1 -2 +1 […]...
- Зворотність реакції – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.5 . Зворотність реакції Відповідно до рівняння Гіббса-Гельмгольца, вільна енергія реакції ∆G0R залежить від температури. Якщо не враховувати залежність температури від ∆H0R і ∆S0R, то рівняння Гіббса-Гельмгольца відповідає рівнянню прямої. Залежно від знаків ∆H0R і ∆S0R розрізняють чотири типи реакції. Тип 1: при температурі Т < Т0 […]...