Розрахунки за хімічними формулами
Тема 1
КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ
УРОК 9
Тема. Розрахунки за хімічними формулами
Цілі уроку: систематизувати знання про кількість речовини, молярну масу, молярний об’єм; удосконалювати навички обчислень за хімічними формулами; підготувати учнів до тематичного оцінювання з теми “Кількість речовини. Розрахунки за хімічними формулами”.
Тип уроку: узагальнення й систематизації знань.
Форми роботи: групова, індивідуальна.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва,
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання
1. Два-три учні пропонують складені вдома задачі на обчислення відносної густини газоподібних речовин.
2. На дошці виписуємо формули зв’язку:
– кількості речовини и маси:  = m/M;
= m/M;
– кількості речовини и числа частинок:  = N/NA;
= N/NA;
– кількості речовини и об’єму газів:  = V/Vm;
= V/Vm;
– попарно взяті кількості речовини реагентів і продуктів реакції:  1/k1 =
1/k1 =  2/k2, де k1 і k2 – коефіцієнти
2/k2, де k1 і k2 – коефіцієнти
– об’ємів газоподібних речовин – реагентів і продуктів реакції: V1/k1 = V2/k2.
III. Узагальнення й систематизація вивченого матеріалу
Групова робота
1. Учні об’єднуються в групи, одержують завдання на аркуші формату А3, виконують відповідні розрахунки, заповнюють вільні клітинки в таблиці. Потім по колу обмінюються аркушами, червоним чорнилом виправляють помилки й вивішують аркуші на дошці.
Після цього по черзі коментують допущені помилки.
Учитель узагальнює відповіді (10-15 хв.).
Варіант І
NaCl | СO2 | H2SO4 |
Т, г | 58,5 | |
М, г/моль | ||
| 2 | |
N, частинок | ||
V, л | 11,2 |
Варіант II
SO2 | Аl(ОН)3 | СuО |
Т, г | 16 | |
М, г/моль | ||
| 12,04 – 1023 | |
N, частинок | ||
V, л | 44,8 |
Варіант III
СаСО3 | CO | HCl |
Т, г | 150 | |
М, г/моль | ||
| ||
N, частинок | 9,03 – 1023 | |
V, л | 56 |
Варіант IV
АlСl3 | N2 | H2CO3 |
Т, г | 26,7 | |
М, г/моль | ||
| 3 | |
N, частинок | ||
V, л | 33,6 |
2. Кожна група одержує завдання (5 хв.)
Обчисліть об’єм вуглекислого газу, що утвориться в результаті згоряння природного газу, який містить метан об’ємом:
Група 1 – 5 л;
Група 2 – 3 л;
Група 3 – 7 л;
Група 4 – 10 л.
Який об’єм кисню з повітря при цьому витрачається?
Записуємо на дошці рівняння реакції й під рівнянням виписуємо відповіді всіх груп.
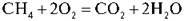
Варіант І | 5 л | 10 л | 5 л |
Варіант II | 3 л | 6 л | 3 л |
Варіант III | 7 л | 14 л | 7 л |
Варіант IV | 10 л | 20 л | 10 л |
3. Яка кількість речовини кисню знадобиться для повного згоряння речовини X кількістю речовини 0,5 моль?
X: група 1 – Аl; група 2 – Р; група 3 – Mg; група 4 – Li.
Кожна група наводить рівняння реакції, складає пропорцію й записує відповідь. Потім групи по колу обмінюються розв’язаннями, перевіряють, виправляють, коментують.
Учитель узагальнює відповіді.
Група 1
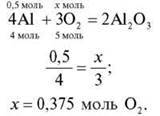
Група 2
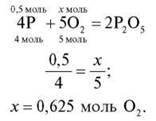
Група 3
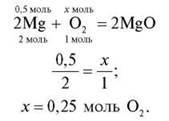
Група 4
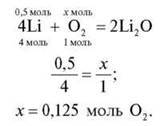
IV. Підбиття підсумків уроку. Рефлексія
Ще раз звертаємо увагу на виписані на дошці формули.
– Де на уроці ми використали ці формули?
– Яка група швидше й правильніше виконувала завдання?
– Які помилки допускалися в процесі виконання завдань?
V. Домашнє завдання
Повторити матеріал теми, підготуватися до тематичного оцінювання.
Творче завдання. Заповнити таблицю.
2Na | +Сl2 | = 2NaCl |
M, г | 4,6 | |
| ||
V, л | – | – |




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Тематичне оцінювання з теми “Кількість речовини. Розрахунки за хімічними формулами” Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 10 Тема. Тематичне оцінювання з теми “Кількість речовини. Розрахунки за хімічними формулами” Цілі уроку: перевірити рівень знань учнів та їх уміння виконувати розрахунки з використанням понять “кількість речовини”, “молярна маса”, “молярний об’єм”, “відносна густина газу”; виявити рівень навчальних досягнень учнів з теми. Тип уроку: контроль знань, […]...
- Обчислення за хімічними формулами молярної маси й кількості речовини Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 6 Тема. Обчислення за хімічними формулами молярної маси й кількості речовини Цілі уроку: поглибити уявлення учнів про молярну масу речовини; навчити використовувати набуті знання для обчислення за хімічними формулами молярної маси, маси й кількості речовини. Тип уроку: формування вмінь і навичок. Форми роботи: керована практика, самостійна […]...
- Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 37 Тема. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції Цілі уроку: розвивати вміння й навички розрахунків за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції; повторити хімічні властивості класів неорганічних сполук, генетичний зв’язок між ними; підготувати учнів до тематичного оцінювання. Тип […]...
- Визначення ступеня окиснення атомів елементів за хімічними формулами сполук Тема 4 ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ УРОК 62 Тема. Визначення ступеня окиснення атомів елементів за хімічними формулами сполук Цілі уроку: розвивати навички визначення ступеня окиснення в сполуках за формулами, а також за будовою атомів, які утворюють ці сполуки; сформувати навички складання хімічних формул за відомими ступенями окиснення атомів. Тип уроку: засвоєння вмінь і навичок. […]...
- Розрахунки за формулами для обчислення кількості речовини – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач І. Розрахунки за формулами для обчислення кількості речовини Формули і поняття, які використовуються: Де n(Х) – кількість речовини X, моль, M(Х) – маса речовини X, г, V(X) – об’єм газу X за нормальних умов, […]...
- Розрахунки за хімічними рівняннями Хімія Загальна хімія Основні поняття, закони й теорії хімії Розрахунки за хімічними рівняннями Розрахунок кількості речовини реагентів і продуктів реакції Задача. Яка кількість речовини водню вступить у реакцію з 2 моль азоту? Яка кількість речовини амоніаку при цьому утвориться? Розв’язання 1) Записуємо рівняння реакції, зрівнюємо його: . 2) Коефіцієнти в даному рівнянні показують співвідношення кількості […]...
- Хімічні формули речовин. Відносна молекулярна маса, її обчислення за хімічними формулами ТЕМА 1. ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ Урок 11. Хімічні формули речовин. Відносна молекулярна маса, її обчислення за хімічними формулами Цілі: на основі знань про хімічні формули речовин вивчити, що таке відносна молекулярна маса речовини; навчитись обчислювати відносну молекулярну масу речовини за її формулою; розвивати знання учнів про хімічну формулу й уміння нею користуватися; розвивати логічне мислення; […]...
- Обчислення кількості атомів (молекул) у певній кількості речовини Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 4 Тема. Обчислення кількості атомів (молекул) у певній кількості речовини Цілі уроку: формувати вміння і практичні навички хімічних обчислень з використанням понять “кількість речовини”, “моль”, “стала Авогадро”. Тип уроку: формування вмінь і навичок. Форми роботи: керована практика, самостійна робота. Обладнання: Періодична система хімічних елементів Д. І. […]...
- Стислі відомості з історії розвитку чорної металургії в Україні. Розв’язання задач на розрахунки за хімічними рівняннями за реагентами, що містять домішки ІІ семестр Тема 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (13 годин) УРОК 26 Тема уроку. Стислі відомості з історії розвитку чорної металургії в Україні. Розв’язання задач на розрахунки за хімічними рівняннями за реагентами, що містять домішки Цілі уроку: дати учням уявлення про історію розвитку та значення чорної металургії в Україні; формувати вміння й навички розв’язання […]...
- Обчислення за хімічними рівняннями РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ § 2. Обчислення за хімічними рівняннями Усвідомлення змісту цього параграфа дає змогу: Опанувати алгоритм розв’язування розрахункової задачі та позначення фізичних величин; Обчислювати масу речовини за відомою кількістю речовини або кількість речовини за відомою масою; об’єм газуватої речовини (н. у.) за відомою масою або кількістю […]...
- Розрахунки за термохімічними рівняннями реакцій РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ IVA ГРУПИ § 46. Розрахунки за термохімічними рівняннями реакцій Усвідомлення змісту цього параграфа дає змогу: обчислювати теплові ефекти хімічних реакцій; Розв’язувати розрахункові задачі за термохімічними рівняннями реакцій. Для обчислень за термохімічними рівняннями реакцій потрібно знати таке. 1. Термохімічними називаються рівняння хімічних реакцій, у яких зазначається тепловий […]...
- Співвідношення об’ємів газів у хімічних реакціях. Обчислення об’ємних співвідношень газів за хімічними рівняннями Тема 3 НАЙВАЖЛИВІШІ ОРГАНІЧНІ СПОЛУКИ Урок 38 Тема уроку. Співвідношення об’ємів газів у хімічних реакціях. Обчислення об’ємних співвідношень газів за хімічними рівняннями Цілі уроку: формувати знання учнів про закон об’ємних співвідношень для газоподібних речовин на прикладі хімічних реакцій органічних речовин; формувати вміння застосовувати закон об’ємних співвідношень для розрахунків за хімічними рівняннями. Тип уроку: формування нових […]...
- Молярна маса Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 5 Тема. Молярна маса Цілі уроку: увести поняття “молярна маса”; ознайомити з одиницею вимірювання молярної маси речовини; показати фізичний зміст молярної маси речовини; пояснити взаємозв’язок між кількістю речовини, масою, молярною масою. Тип уроку: комбінований. Форми роботи: керована практика, самостійна робота. Обладнання: Періодична система хімічних елементів Д. […]...
- РОЗРАХУНКИ ЗА РІВНЯННЯМИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник КІЛЬКІСНІ ВІДНОШЕННЯ В ХІМІЇ РОЗРАХУНКИ ЗА РІВНЯННЯМИ ХІМІЧНИХ РЕАКЦІЙ Розглянемо наступний приклад: обчислимо масу метану, необхідного для виробництва 1000 т сажі. Розв’язання хімічної задачі має починатися із запису рівняння реакції: Над формулами речовин, кількості яких (або якої) дані в умові задачі, зазначимо ці кількості й позначимо літерою х кількість речовини, що […]...
- Кількість речовини. Моль Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 3 Тема. Кількість речовини. Моль – одиниця кількості речовини. Стала Авогадро Цілі уроку: сформувати уявлення учнів про хімічне поняття “кількість речовини”; показати сутність фізичної величини кількості речовини; ознайомити з одиницею вимірювання кількості речовини; увести поняття “моль”, “стала Авогадро”. Тип уроку: вивчення нового матеріалу. Форми роботи: розповідь […]...
- Розрахунки за рівняннями хімічних реакцій між розчином солі та металом РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ § 53. Розрахунки за рівняннями хімічних реакцій між розчином солі та металом Усвідомлення змісту цього параграфа дає змогу: Пояснювати суть і причини зміни маси пластинки в зазначених реакціях; Розв’язувати задачі “на пластинку”. Задачі такого типу засновані на закономірностях витискувального ряду металів. Як ви уже знаєте, показником порівняльної хімічної […]...
- ОДИНИЦЯ КІЛЬКОСТІ РЕЧОВИНИ – МОЛЬ Хімія – універсальний довідник КІЛЬКІСНІ ВІДНОШЕННЯ В ХІМІЇ ОДИНИЦЯ КІЛЬКОСТІ РЕЧОВИНИ – МОЛЬ Речовини, що вступають в хімічну взаємодію, можуть складатися з атомів, або молекул, або інших частинок. Кількість речовини, що реагує, зручно характеризувати числом таких частинок. Одиницею кількості речовини, що визначає число частинок, з яких ця речовина складається, є моль. Кількість речовини, виражена в […]...
- Приклади розв’язування типових задач (розрахунки за термохімічними рівняннями) – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач (розрахунки за термохімічними рівняннями) Задача 1. За наведеним термохімічним рівнянням добування аміаку Обчисліть: а) кількість теплоти, що виділяється під час утворення 5 моль аміаку; б) об’єм водню (н. у.), що прореагував, якщо під час реакції виділилось […]...
- Складання формул бінарних сполук за валентністю атомів елементів. Визначення валентності за формулами бінарних сполук Тема 1 ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ Урок 13 Тема. Складання формул бінарних сполук за валентністю атомів елементів. Визначення валентності за формулами бінарних сполук Цілі: продовжити формування вмінь на підставі знань валентності складати хімічні формули бінарних сполук і за формулами визначати валентності атомів хімічних елементів; узагальнити й поглибити знання про зміст хімічної формули, склад простих і складних […]...
- Відносна густина газів. Обчислення відносної густини Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 8 Тема. Відносна густина газів. Обчислення відносної густини Цілі уроку: розкрити суть поняття “відносна густина газів”; навчити учнів здійснювати розрахунки відносної густини газів, обчислення молярної маси за відомою відносною густиною; показати практичне значення цих розрахунків. Тип уроку: засвоєння нових знань. Форми роботи: розповідь учителя, керована практика, […]...
- Оксиди в природі. Використання оксидів Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 17 Тема. Оксиди в природі. Використання оксидів Цілі уроку: поглибити знання про класи неорганічних сполук на прикладі фізичних і хімічних властивостей оксидів; розвивати вміння й навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей оксидів, навички виконання обчислень за хімічними формулами; ознайомити учнів з поширенням оксидів у природі; […]...
- Обчислення за рівнянням хімічної реакції, якщо один з реагентів узято в надлишку РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ VIIA ГРУПИ § 22. Обчислення за рівнянням хімічної реакції, якщо один з реагентів узято в надлишку Усвідомлення змісту цього параграфа дає змогу: розв’язувати задачі на надлишок. Розглянемо рівняння реакції водню з хлором: За яким водень масою 2 г реагує з хлором масою 71 г з утворенням […]...
- Хімічні символи, формули і рівняння ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ § 1.7. Хімічні символи, формули і рівняння Елементи прийнято позначати хімічними символами (знаками). Символ елемента складається з першої літери або з першої й однієї з наступних літер латинської назви елемента; перша літера завжди велика, друга […]...
- Молярний об’єм газів. Обчислення об’єму газу за нормальних умов Тема 1 КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ УРОК 7 Тема. Молярний об’єм газів. Обчислення об’єму газу за нормальних умов Цілі уроку: ознайомити учнів з поняттям “молярний об’єм”; розкрити особливості використання поняття “молярний об’єм” для газоподібних речовин; навчити учнів використовувати отримані знання для розрахунків об’ємів газів за нормальних умов. Тип уроку: комбінований. Форми роботи: розповідь […]...
- ДЕЯКІ ФІЗИЧНІ ВЕЛИЧИНИ І ЇХ ОДИНИЦІ – ЗАКОНИ ЗБЕРЕЖЕННЯ. СТЕХІОМЕТРІЯ Хімія – універсальний довідник ЗАКОНИ ЗБЕРЕЖЕННЯ. СТЕХІОМЕТРІЯ У хімічних реакціях атоми не утворюються заново і не руйнуються. Цей факт відображають закони стехіометрії. Маса речовин, які вступили в хімічну реакцію, дорівнює масі речовин, які утворилися в результаті реакції (закон збереження маси). Об’єми газів, що реагують, відносяться один до одного і до об’єму отриманих газів як прості […]...
- Розрахунки за рівняннями хімічних реакцій – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач II. Розрахунки за рівняннями хімічних реакцій Задача 7. Який об’єм водню (н. у.) витратиться на відновлення 0,4 моль хром(ІІІ) оксиду? Дано: Розв’язання Запишемо рівняння реакції: 1. З написаного рівняння видно, що 2. Для знаходження об’єму водню […]...
- Зміна тиску – Чинники, що впливають на зміщення хімічної рівноваги ХІМІЧНА РІВНОВАГА 2 . Чинники, що впливають на зміщення хімічної рівноваги 2.2 . Зміна тиску Реакції рівноваги, в яких беруть участь гази, часто супроводжуються зміною кількості частинок. Приклад. При синтезі амоніаку з простих речовин реагують між собою 3 моль водню і 1 моль азоту та утворюється 2 моль амоніаку: 3Н2 + N2 2NH3. Кількість частинок […]...
- Визначення констант рівноваги – Характеристики хімічної рівноваги ХІМІЧНА РІВНОВАГА 1. Характеристики хімічної рівноваги 1.3. Визначення констант рівноваги Знаючи концентрації речовин, що знаходяться в стані рівноваги, можна обчислити відповідну константу рівноваги. Приклад. Початкова кількість речовини n0 = 1 моль гідроген йодиду в реакції з утворенням водню і йоду при температурі Т = 446 °С розпалася n = 0,22 моль (н. у.). Відповідно до […]...
- ЗАКОН ГЕССА. РОЗРАХУНОК ЕНТАЛЬПІЇ ХІМІЧНОЇ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ЗАКОН ГЕССА. РОЗРАХУНОК ЕНТАЛЬПІЇ ХІМІЧНОЇ РЕАКЦІЇ Тепловий ефект реакції залежить від початкового і кінцевого станів системи і не залежить від шляху реакції (закон Гесса). Наприклад: Кількість теплоти, яка виділяється під час спалювання метану СН4, не залежить від того, протікає реакція за одну стадію чи за дві […]...
- Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів. Визначення валентності за формулами бінарних сполук ТЕМА 1. ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ Урок 6. Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів. Визначення валентності за формулами бінарних сполук Цілі: сформувати поняття про валентність, одиницю валентності, навчити учнів визначати валентність елементів у бінарних сполуках, складати формули сполук за валентністю; розвивати логічне мислення та творчі здібності. Обладнання: періодична таблиця елементів. Тип уроку: […]...
- Відсоткові розрахунки. Формула складних відсотків УРОК № 42 Тема. Відсоткові розрахунки. Формула складних відсотків Мета уроку: закріпити знання учнів про формули розв’язування основних задач на відсотки. Продовжити роботу над виробленням умінь застосовувати вивчені формули для розв’язування задач на відсоткові розрахунки. Повторити розв’язання задач на складання та розв’язування математичних моделей. Тип уроку: закріплення знань, відпрацювання вмінь. Наочність та обладнання: опорний конспект […]...
- Моль. Молярна маса ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ § 1.6. Моль. Молярна маса У Міжнародній системі одиниць (Сl) за одиницю кількості речовини прийнято моль. Моль – це кількість речовини, що містить стільки структурних одиниць (молекул, атомів, іонів, електронів чи інших), скільки атомів міститься […]...
- Кількість речовини, молярна маса ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина 1.7. Кількість речовини, молярна маса Кількість речовини п (або V, ню) – це фізична величина, яка визначає кількість частинок (молекул, атомів, йонів, йонних угруповань – асоціатів) у певній її порції. Одиницею вимірювання кількості речовини є моль. Моль – […]...
- Кількість речовини. Стала Авогадро. Молярна маса Хімія Загальна хімія Основні поняття, закони й теорії хімії Кількість речовини. Стала Авогадро. Молярна маса Кількість речовини (n) – це визначене число будь-яких структурних одиниць (атомів, молекул, іонів тощо). Одиниця виміру кількості речовини – Моль. В 1 моль число будь-яких частинок дорівнює , тобто стільки ж, скільки міститься в 0,012 кг вуглецю. Це число визначене […]...
- Узагальнення і систематизація знань ТЕМА 1. ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ Урок 19. Узагальнення і систематизація знань Цілі: узагальнити набуті знання, вміти використовувати їх під час виконання завдань різного типу. Обладнання: періодична таблиця хімічних елементів. Тип уроку: узагальнююче повторення. Форми роботи: хімічна розминка, самостійна робота, робота в групах, прес-конференція. ХІД УРОКУ I. Організація класу II. Оголошення теми й мети уроку III. […]...
- ЕНТРОПІЯ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ЕНТРОПІЯ Ентропію можна охарактеризувати, як ступінь безладдя (невпорядкованості) системи. Ентропію речовини прийнято відносити до стандартних умов: до тиску р = 101 325 Па (1 атм) і, зазвичай, до температури 298 К (25 °С). Ентропія 1 моль речовини у стандартному стані називається стандартною молярною ентропією. Її позначають […]...
- Тема 2. Закон збереження маси. Кількість речовини – ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Тема 2. Закон збереження маси. Кількість речовини Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Позначте прізвище вченого, ім’ям якого названо число частинок, що міститься в 1 моль будь-якої речовини: A. Менделєєв; Б. […]...
- Експортно-імпортні розрахунки підприємств Експортно-імпортні розрахунки підприємств – міжнародні розрахунки, що регулюють платежі за грошовими вимогами і зобов’язаннями між підприємствами, організаціями та зовнішньоторговельними фірмами різних країн, які займаються експортно-імпортними операціями товарів і послуг. З цією метою вони відкривають у банках розрахункові, суброзрахункові, кредитні, спеціальні та інші рахунки, які ведуться в національній валюті і поділяються на декілька основних груп. Такі […]...
- Міжнародні розрахунки Міжнародні розрахунки – грошові розрахунки між державами, підприємствами, організаціями, банками, окремими особами різних країн. Пов’язані із зовнішньою торгівлею, кредитами, інвестиціями, транспортними послугами, туризмом, утриманням дипломатичних представництв, різними некомерційними переказами коштів за кордон. Головне місце займають розрахунки зовнішньої торгівлі. Загальні умови розрахунків оформляються міжнародними угодами, М. р. за торговельними операціями здійснюються на неоднакових умовах, у різноманітних […]...
- Обчислення виходу продукту РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ VA ГРУПИ § 34. Обчислення виходу продукту Усвідомлення змісту цього параграфа дає змогу: Формулювати означення поняття “вихід продукту”; висловлювати судження про його значення для оцінки ефективності виробництва; – розв’язувати задачі означеного типу. Ви уже знаєте, як проводити розрахунки за хімічними рівняннями, якщо один з реагентів узято […]...