Сірка – Елементи VIA групи
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
9. Неметалічні елементи та їхні сполуки. Неметали
9.3. Елементи VIA Групи
9.3.6. Сірка
Алотропні видозміни сірки
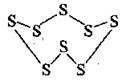
Атоми Сульфуру утворюють стабільні ланцюжки і цикли. Відомо понад 10 алотропних видозмін сірки. Найстійкішими серед них є 2 модифікації (моноклінна та ромбічна), які утворені циклічними короноподібними молекулами S8:
Та аморфна сірка (пластична, гумоподібна).
Ромбічна, або а-сірка найстійкіша,
Це гумоподібна коричнева маса, яка на повітрі доводі швидко перетворюється на ромбічну сірку.
За температури 150 °С ще зберігаються молекули сірки складу S8; після її закипання (445 °С) з подальшим підвищенням температури кількість атомів у молекулі зменшується: S6 → S4 → S2(900 °С), а при 1700 °С пари містять лише одноатомні молекули S.
Поширеність у природі
Сульфур у природі існує у вільному (самородна сірка) і зв’язаному станах (нафта, кам’яне вугілля, у складі білків міститься в рослинних і тваринних організмах), але найчастіше Сульфур трапляється у складі мінералів. Основні з них: залізний колчедан (пірит)- FeS2, свинцевий блиск (галеніт) – PbS, кіновар – HgS, мідний блиск – Cu2S, цинкова обманка – ZnS, срібний блиск – Ag2S, гіпс – CaSO4 · 2Н20, халькопірит – CuFeS2, гірка сіль (мірабіліт, англійська сіль) – MgSO4 · 7Н2O, глауберова сіль – Na2SO4 · 10Н2O.
Добування сірки
У лабораторних умовах сірку можна одержати кількома способами:
1. При зливанні розчинів сірководневої та сульфітної кислот:
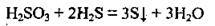
2. При неповному окисненні сірководню:
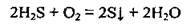
3. При нагріванні піриту до 600 °С без доступу кисню:
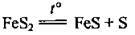
Хімічні властивості сірки
Сірка – типовий неметал, який за звичайних умов не відзначається високою реакційною здатністю. Вона реагує з простими і складними речовинами при нагріванні, виявляючи як окисні, так і відновні властивості. Це залежить від того, які окисно-відновні властивості характерні для речовини, з якою реагує сірка.
1. При нагріванні сірка взаємодіє з простими речовинами (металами та неметалами), крім азоту, благородних газів, іридію, платини та золота. При цьому вона виявляє окисні властивості:
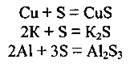
За кімнатної температури із сіркою реагує лише ртуть1:
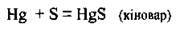
З неметалами сірка реагує як відновник. Реакції відбуваються при нагріванні:
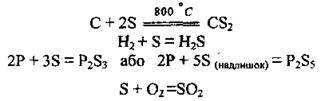
За нормальних умов сірка згоряє у фторі:
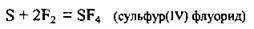
При нагріванні утворюється сульфур(VІ) флуорид:
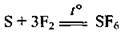
2. Сірка взаємодіє з кислотами, які є сильними окисниками:
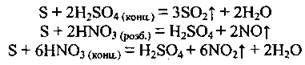
3. При взаємодії з концентрованими розчинами лугів сірка диспропорціонує. Реакцію проводять при кип’ятінні:
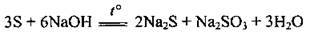
Використання сірки
Сірку використовують для боротьби зі шкідниками у сільському господарстві, у виробництві сульфатної кислоти, сульфітів, сірників, вибухових речовин або вибухових сумішей (чорний порох), гуми, лікарських препаратів для лікування шкірних захворювань, для синтезу сульфурорганічних фармацевтичних препаратів.
