Складання рівнянь окисно-відновних реакцій – Хімічна реакція
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
4. Хімічна реакція
4.6. Складання рівнянь окисно-відновних реакцій
Для складання рівнянь окисно-відновних реакцій використовують метод електронного балансу. Він грунтується на положенні, що загальна кількість електронів, які віддає відновник, має дорівнювати загальній кількості електронів, які приєднує окисник. Розгляньмо основні етапи написання окисно-відновних реакцій на прикладі:
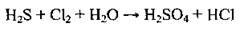
1. Визначаємо
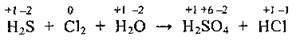
2. Визначаємо речовини, які виявляють відновні та окисні властивості: сірководень H2S – відновник (ступінь окиснення Сульфуру найнижчий), хлор Сl2 – окисник.
3. Складаємо електронні схеми процесів окиснення і відновлення:
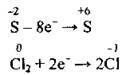
4. Виставляємо біля процесів окиснення – відновлення множники 2 і 8, скорочуємо на 2 (спільний дільник), отримуємо 1 і 4:
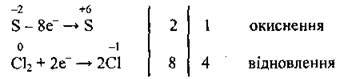
5. Знайдені множники записуємо як коефіцієнти перед формулами речовин, які беруть участь у процесах окиснення і відновлення. Після того зрівнюємо інші хімічні елементи:
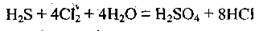
Кількість електронів, які віддає Сульфур (8е-), тепер дорівнює кількості електронів, які приєднають 4 молекули Сl2 (також 8е-).




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Типи окисно-відновних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.7. Типи окисно-відновних реакцій Розрізняють 3 типи окисно-відновних реакцій: міжмолекулярні, внутрішньо-молекулярні та реакції диспропорціонування. 1. Міжмолекулярні окисно-відновні реакції У таких реакціях елемент, що віддає електрони, та елемент, що їх приєднує, містяться в складі різних молекул. Наприклад: 2. Внутрішньо-молекулярні окисно-відновні реакції […]...
- СКЛАДАННЯ РІВНЯНЬ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ З ВИКОРИСТАННЯМ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ СКЛАДАННЯ РІВНЯНЬ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ З ВИКОРИСТАННЯМ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ Окисник – речовина, що містить елемент, у якого в ході реакції ступінь окиснення знижується внаслідок прийому електронів; процес приєднання електронів називається відновленням. Відновник – це речовина, що містить елемент, у якого в ході реакції […]...
- IОННО-ЕЛЕКТРОННИЙ МЕТОД СКЛАДАННЯ РІВНЯНЬ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ IОННО-ЕЛЕКТРОННИЙ МЕТОД СКЛАДАННЯ РІВНЯНЬ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ Іонно-електронний метод – це метод напівреакцій. Наприклад: Кількість молів приєднаних електронів дорівнює кількості молів втрачених електронів:...
- Складання рівнянь окисно-відновних реакцій – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.3. Складання рівнянь окисно-відновних реакцій Застосовуються два методи складання рівнянь окисно – відновних реакцій – метод електронного балансу і метод напівреакцій. Метод електронного балансу. За цим методом порівнюють ступені окиснення атомів у вихідних і кінцевих речовинах, […]...
- Зміна ступеню окиснення – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.5. Зміна ступеню окиснення Процес віддачі електронів атомом, молекулою або йоном називають окисненням. Атоми, молекули або йони, що віддають електрони, називають відновниками. Під час реакцій вони окислюються: Процес приєднання електронів атомом, молекулою або йоном називають відновленням. Атоми, молекули або йони, […]...
- Теорія окисно-відновних реакцій – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.1. Теорія окисно-відновних реакцій Усі хімічні реакції можна розділити на два типи. До першого належать реакції, які відбуваються без зміни ступеня окиснення атомів, що входять до складу реагуючих речовин. Наприклад: +1 +5 -2 +1 -2 +1 […]...
- Класифікація окисно-відновних реакцій – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.5. Класифікація окисно-відновних реакцій Звичайно розрізняють три типи окисно-відновних реакцій: міжмолекулярні, внутрішньомолекулярні і реакції диспропорціонування. До міжмолекулярних належать реакції, у яких окисник і відновник входять до складу різних речовин. Розглянуті в §7.3 І 7.4 реакції належать […]...
- Рівновага в окисно-відновних реакціях – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції Окисно-відновна реакція складається з двох напівреакцій: напівреакції окиснення і напівреакції відновлення. Окиснення – це віддача електронів, відновлення – отримання електронів. Приклад. При згоранні магнію атоми Магнію окислюються, а молекули кисню відновлюються. При цьому кожен атом Магнію віддає два електрони кожному атому Оксигену. 1.1. Рівновага в окисно-відновних реакціях На відміну […]...
- Складання рівнянь окисно-відновних реакцій – ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Складання рівнянь окисно-відновних Реакцій При складанні рівнянь ОВР дуже часто користаються методом електронного балансу та методом електронно-іонного балансу (метод напівреакцій). їх використовують для підбору стехіометричних коефіцієнтів у рівняннях ОВР. Метод електронного балансу Суть методу знаходження стехіометричних коефіцієнтів у рівняннях ОВР полягає […]...
- НАПРЯМОК ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ У РОЗЧИНІ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ НАПРЯМОК ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ У РОЗЧИНІ Для кількісної характеристики окисно-відновних можливостей речовин, що знаходяться в розчинах або стикаються з ними, використовують електродні (окисно-відновні) потенціали Е. Взаємозв’язок ΔG і Е виражається рівнянням Де n – число молів електронів, переданих у процесі; F = 96 485 […]...
- Складання найпростіших окисно-відновних реакцій, підбір коефіцієнтів Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 28 Тема уроку. Складання найпростіших окисно-відновних реакцій, підбір коефіцієнтів Цілі уроку: розвивати навички складання окисно-відновних реакцій; закріпити навички складання хімічних рівнянь на прикладі найпростіших окисно-відновних реакцій, застосування методу електронного балансу для розміщення коефіцієнтів у рівняннях хімічних реакцій, що протікають зі зміною ступеня окиснення. Тип уроку: узагальнення й систематизації знань, умінь […]...
- Окисно-відновні реакції Тема 4 ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ УРОК 64 Тема. Окисно-відновні реакції Цілі уроку: поглибити знання учнів про ступінь окиснення на прикладі окисно-відновних реакцій; розвивати навички написання хімічних рівнянь на прикладі найпростіших окисно-відновних реакцій; відпрацювати навички й уміння визначати ступені окиснення атомів хімічних елементів за хімічною формулою. Тип уроку: узагальнення й систематизації знань, умінь і […]...
- Хімічні реакції. Схеми реакцій, хімічні рівняння – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.1. Хімічні реакції. Схеми реакцій, хімічні рівняння Хімічними реакціями називають перетворення однієї чи декількох речовин, які відрізняються одна від одної складом чи будовою молекули, на інші. Речовини, які вступають у хімічні реакції, називають вихідними речовинами, або реагентами, а речовини, які […]...
- ОКИСНО-ВІДНОВНІ РЕАКЦІЇ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ ОКИСНО-ВІДНОВНІ РЕАКЦІЇ Окисно-відновні реакції проходять за рахунок переходу електронів або атомів від одних частинок до інших. У реакції Відбувається перехід електронів від атомів заліза (відновник) до іонів Купруму (окисник). В реакції Відбувається перехід атомів Оксигену від іонів СlO – (окисник) до йонів SO32- […]...
- Окисно-відновні реакції – ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Окисно-відновні реакції За зміною ступенів окиснення елементів, що входять до складу реагентів та продуктів реакції, усі хімічні реакції можна розділити на дві групи, а саме на: 1) Реакції, що протікають без зміни ступенів окиснення всіх елементів. До таких реакцій належать, зокрема, […]...
- Окисно-відновні реакції, їх значення Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 27 Тема уроку. Окисно-відновні реакції, їх значення Цілі уроку: розширити знання учнів про хімічні реакції на прикладі окисно-відновних; закріпити навички складання хімічних рівнянь на прикладі найпростіших окисно-відновних реакцій, застосування методу електронного балансу для розміщення коефіцієнтів у рівняннях хімічних реакцій, що протікають зі зміною ступеня окиснення. Тип уроку: узагальнення й систематизації […]...
- Окисно-відновні реакції РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ § 10. Окисно-відновні реакції Усвідомлення змісту цього параграфа дає змогу: Пояснювати значення окисно-відновних реакцій, суть процесів окиснення й відновлення, понять окисник і відновник; визначати окисник і відновник; складати схеми електронного балансу; Розставляти коефіцієнти у рівняннях окисно-відновних реакцій. Пригадаємо означення: Реакції, під час яких змінюються […]...
- Тести – Урок 4 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Тести 4.1 Установіть відповідність реагентів з типом реакції, що між ними відбувається Реагенти: Тип реакції: 1 магній оксид і нітратна кислота А сполучення 2 магній і хлор Б заміщення 3 магній і хлоридна кислота В обмін 4 магній нітрид і […]...
- Енергетика хімічних реакцій. Тепловий ефект реакції – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.4. Енергетика хімічних реакцій. Тепловий ефект реакції Як відомо із закону збереження енергії, енергія не виникає з нічого і не зникає безслідно. Речовини, що вступають у хімічну реакцію (реагенти), мають певний запас енергії (внутрішньої енергії). Під час хімічної реакції руйнуються […]...
- Типи хімічних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.3. Типи хімічних реакцій Хімічні реакції класифікують за різними ознаками: – за фазовим станом середовища; – за типом перетворення реагентів; – за тепловим ефектом; – за ознакою зміни ступенів окиснення; – за оборотністю. Фазовий стан середовища Залежно від фазового стану […]...
- Вплив середовища на характер перебігу реакцій – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.4. Вплив середовища на характер перебігу реакцій Реакції окиснення – відновлення можуть відбуватися в різних середовищах: у кислому (надлишок Н+-іонів), нейтральному (Н2О) і лужному (надлишок гідроксид-іонів ОН – ). Залежно від середовища може змінюватись і характер […]...
- Хімічна рівновага – Оборотність хімічних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.9. Оборотність хімічних реакцій За цією ознакою розрізняють: – реакції, які за однакових умов відбуваються у двох протилежних напрямках, називають оборотними. Наприклад, реакція синтезу сульфур(VI) оксиду (знак вказує саме на оборотність реакції): – необоротними називають реакції, які відбуваються тільки в […]...
- Складання формул сполук за відомим ступенем окиснення атомів елементів Тема 4 ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ УРОК 63 Тема. Складання формул сполук за відомим ступенем окиснення атомів елементів Цілі уроку: закріпити навички складання хімічних формул за відомими ступенями окиснення атомів, визначення ступенів окиснення; розширити уявлення про хімічні реакції на прикладі хімічних реакцій зі зміною ступеня окиснення атомів; показати єдність двох процесів – окиснення й […]...
- Рівняння окисно-відновної реакції – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції 1.3. Рівняння окисно-відновної реакції Дуже часто важко скласти рівняння окисно-відновної реакції, якщо невідомо, як саме реагують речовини одна з одною. Використовуючи ступінь окиснення елементів, цю проблему можна вирішити. Перед складанням рівняння окисно-відновної реакції потрібно знати наступне: – який продукт окиснення і продукт відновлення утворюється; – чи проходить реакція в […]...
- Розрахунки за рівняннями хімічних реакцій – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач II. Розрахунки за рівняннями хімічних реакцій Задача 7. Який об’єм водню (н. у.) витратиться на відновлення 0,4 моль хром(ІІІ) оксиду? Дано: Розв’язання Запишемо рівняння реакції: 1. З написаного рівняння видно, що 2. Для знаходження об’єму водню […]...
- Окисно-відновні реакції. Метод електронного балансу Хімія Загальна хімія Окисно-відновні реакції. Метод електронного балансу Реакції, які відбуваються зі зміною ступенів окиснення елементів реагуючих речовин, називаються окисно-відновнимИ. Атоми, які під час утворення хімічних зв’язків у сполуці “приймають” електрони від інших менш електронегативних атомів, називаються окисникамИ. Процес “прийому” електронів називається відновленняМ. Атоми, які під час утворення хімічних зв’язків у сполуці “віддають” електрони іншим […]...
- ОКИСНЕННЯ – ВІДНОВЛЕННЯ Хімія – універсальний довідник ГАЛОГЕНИ ОКИСНЕННЯ – ВІДНОВЛЕННЯ Суть реакції між металом і галогеном полягає у втраті електронів атомами одного елемента (у даному випадку металу) і приєднанні цих електронів атомами іншого елемента (галогену). Такі реакції називаються окисно-відновними. Процес віддачі електронів називається окисненням; процес приєднання електронів – відновленням. Речовина, що приймає електрони, називається окисником; речовина, що […]...
- Суть електролізу – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.6. Суть електролізу У розчинах і розплавах електролітів є різнойменні за знаками іони (катіони й аніони), які подібно до всіх частинок рідини перебувають у хаотичному русі. Якщо в такий розчин або розплав електроліту, наприклад у розплав […]...
- Тема 10. Окисно-відновні реакції Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ БУДОВА РЕЧОВИНИ Тема 10. Окисно-відновні реакції Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Вкажіть схему, що відповідає перетворенню Мg° → Мg+2: 2. Вкажіть схему, що відповідає перетворенню N0 → N-3: 3. Вкажіть схему, що відповідає перетворенню N0 → N+3: […]...
- Розв’язування типових задач – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.9. Розв’язування типових задач Окисно-відновні реакції Задача 1. Доберіть коефіцієнти у схемі окисно-відновної реакції: S + HNO3 −> H2SO4 + NO. Розв’язання. Коефіцієнти знаходимо методом електронного балансу. Зазначимо ступені окиснення елементів, які їх змінюють: 0 +5 […]...
- ПАЛИВНИЙ ЕЛЕМЕНТ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ ПАЛИВНИЙ ЕЛЕМЕНТ Паливний елемент – гальванічний елемент, у якому окисно-відновна реакція підтримується безперервною подачею реагентів (окисника і відновника) та видаленням продуктів реакції. У воднево-кисневому елементі (рис. 40) в електричну енергію перетворюється енергія хімічної реакції Рис. 40. Схема паливного елемента. Електроліт – розчин лугу. […]...
- Процеси окиснення, відновлення. Окисники, відновники Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 26 Тема уроку. Процеси окиснення, відновлення. Окисники, відновники Цілі уроку: розширити уявлення про хімічні реакції на прикладі реакцій окиснення й відновлення; сформувати знання про процеси окиснення й відновлення; показати єдність двох протилежних процесів: окиснення й відновлення – як властивості атомів віддавати та приєднувати електрони; ознайомити учнів із прикладами окисників і […]...
- Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач Суть розв’язування задач цього типу полягає в розстановці коефіцієнтів і перетворенні схем реакцій на рівняння. Задача 1. Схема реакції: Ставимо коефіцієнт 4 перед формулами NH3 і NO, а коефіцієнт 5 – перед формулою O2: Залишається дібрати […]...
- Швидкість хімічної реакції. Каталізатор – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.8. Швидкість хімічної реакції. Каталізатор Розділ хімії, що вивчає швидкість хімічних реакцій, називають хімічною кінетикою. Розгляньмо зміст деяких понять, які використовують у цьому розділі. Швидкість хімічних реакцій характеризується зміною концентрації реагентів (або продуктів реакції) за одиницю часу. Якщо реакції відбуваються […]...
- Ступінь окиснення – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції 1.2. Ступінь окиснення Водень і хлор реагують під час яскраво вираженої екзотермічної реакції, перетворюючись на гідроген хлорид: Н2 + Сl2 → 2НСl. Ця реакція також окисно-відновна, хоча в цьому випадку, власне, переходу електронів не відбувається. У молекулі гідроген хлориду атом Гідрогену зв’язаний з атомом Хлору спільною парою електронів. Щоб […]...
- Приклади розв’язування типових задач (розрахунки за термохімічними рівняннями) – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач (розрахунки за термохімічними рівняннями) Задача 1. За наведеним термохімічним рівнянням добування аміаку Обчисліть: а) кількість теплоти, що виділяється під час утворення 5 моль аміаку; б) об’єм водню (н. у.), що прореагував, якщо під час реакції виділилось […]...
- Тема 27. Нітратна кислота Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ НЕОРГАНІЧНА ХІМІЯ Тема 27. Нітратна кислота Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Укажіть речовини, при взаємодії яких утворюється жовтий осад: A. Карбон(ІІ) оксид та кисень; Б. Натрій нітрит та хлоридна кислота; B. Натрій фосфат та аргентум нітрат; Г. […]...
- КАТАЛІЗ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ КАТАЛІЗ Каталіз – це зміна швидкості хімічної реакції речовинами (каталізаторами), які беруть участь у реакції, але не входять до складу кінцевих продуктів. За участю каталізатора хімічна рівновага системи досягається швидше, ніж без нього. Вплив у каталізатора на швидкість реакції досягають за рахунок […]...
- ЕНЕРГІЯ АКТИВАЦІЇ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ ЕНЕРГІЯ АКТИВАЦІЇ Енергія активації Еа – надлишкова енергія, яку повинні мати молекули, щоб у результаті їхнього зіткнення відбулася хімічна реакція. Хімічна реакція Здійснюється через утворення активованого комплексу А2 … В2, в якому відбувається перегрупування атомів (рис. 44): Рис. 44. Енергетична схема проходження […]...
- Електроліз розплавів – Електроліз ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.13. Електроліз Електроліз – це сукупність окисно-відновних процесів, які відбуваються на електродах під час проходження електричного струму крізь розчин або розплав електроліту. Якщо крізь розчин електроліту пропускати постійний електричний струм, то позитивно заряджені частинки (катіони) будуть рухатися до катода […]...