Структура періодичної системи у світлі теорії будови атома
Тема 3
ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА. БУДОВА АТОМА
УРОК 49
Тема. Структура періодичної системи у світлі теорії будови атома
Цілі уроку: розширити знання учнів про періодичну систему хімічних елементів; на підставі знань про будову атома й будови електронних оболонок атомів показати взаємозв’язок між розміщенням хімічних елементів у періодичній системі та їхніми властивостями; показати взаємозв’язок періодичної зміни електронних структур атомів хімічних елементів та їх властивостей.
Тип
Форми роботи: фронтальне опитування, виконання тренувальних вправ.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, актуалізація опорних знань
Аналіз письмової самостійної роботи.
Фронтальне опитування (робота з періодичною системою хімічних елементів Д. І. Менделєєва)
1. Скільки енергетичних рівнів, заповнених електронами, мають атоми елементів з порядковими номерами:
А) 17;
Б) 29;
В) 42?
Складіть схему будови атома й електронну
2. Напишіть електронні формули елементів:
А) Фосфор;
Б) Калій;
В) Аргон;
Г) Магній;
Д)* Скандій.
3. Розподіліть на p-підрівні:
А) три електрони;
Б) чотири електрони;
В) шість електронів.
4. Електронна формула атома має закінчення…3р3. Напишіть повну електронну формулу цього елемента, визначте його порядковий номер і назву.
5. Складіть схему взаємозв’язку понять у періодичній системі й будови атомів. (Учні під керівництвом учителя складають схему.)
Поняття в періодичній системі | Будова атома |
А. Порядковий номер елемента | А) Величина заряду ядра; Б) кількість протонів; В) кількість електронів |
Б. Номер періоду | Число енергетичних рівнів, головне квантове число |
В. Номер групи | А) Максимальна кількість електронів у атомі, які можуть брати участь в утворенні хімічних зв’язків (валентні електрони); Б) для елементів головних підгруп – кількість електронів на зовнішньому рівні |
Г. Зміна властивостей у періодах | А) Зростає заряд ядра – зростає порядковий номер; Б) збільшується кількість електронів на зовнішньому рівні; В) збільшується сила притягання електронів зовнішнього рівня до ядра; Г) число енергетичних рівнів однакове; Д) спостерігається стискання енергетичних рівнів, радіус атомів незначною мірою зменшується; Е) чим більша кількість електронів на зовнішньому рівні, тим важче атому віддавати електрони й тим легше приєднувати електрони інших атомів |
Д. Зміна властивостей у групах | А) Зростає заряд ядра – зростає порядковий номер; Б) збільшується число енергетичних рівнів; В) кількість електронів на зовнішньому рівні однакова; Г) розмір атома збільшується; Д) слабшає сила притягання електронів зовнішнього рівня до ядра; Е) чим більший радіус атома й менша кількість електронів, тим легше атом віддає електрони й важче приєднує електрони інших атомів |
6. Інертні елементи мають таку електронну формулу зовнішнього енергетичного рівня: ns2np6. Запишіть електронні формули атомів Неону й Аргону. Проаналізуємо ці формули.
– Скільки вільних квантових комірок на зовнішньому рівні?
– Яка кількість неспарених електронів?
– Скільки пар електронів на зовнішньому рівні?
– Скільки електронів може приєднати атом?
– Чому?
Тому що зовнішній енергетичний рівень атомів Неону й Аргону завершений.
III. Практика на прикладах
Завдання 7. Складіть схему будови атома Натрію та іона Na+.
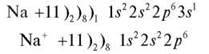
Схема будови якого атома така сама, як і іона Натрію?
Завдання 8. Складіть схему будови атома Флуору та іона F-.
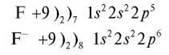
Схема будови якого атома така сама, як і іона Флуору?
Завдання 9. Самостійно побудувати схему будови атома та іона:
А) Магнію;
Б) Хлору
Завдання 10. Подумайте і складіть схему будови іонів S-2, S+4, S+6. Порівняйте будови атома Сульфуру та іонів Сульфуру. Чим вони відрізняються? Чим вони подібні?
Завдання 11. У періодичній системі групи поділяються на головні й побічні. Вони включають елементи, подібні за будовою атома.
Елементи, в яких останній заповнюваний підрівень – s, називають s-елементами. В яких групах розташовуються s-елементи? (У I, II групах, головній підгрупі)
Завдання 12. Використовуючи періодичну систему хімічних елементів, наведіть приклади p-елементів.
Елементи, в яких останній заповнюваний електронами підрівень – р, називають p-елементами. В яких групах періодичної системи перебувають p-елементи? (У III-VIII групах, головній підгрупі)
Завдання 13. Використовуючи періодичну систему хімічних елементів, наведіть приклади p-елементів.
У побічних підгрупах розташовані елементи, в атомах яких електронами заповнюється (d-підрівень, – це d-елементи. На зовнішньому рівні в атомах цих хімічних елементах перебуває один-два s-електрони. Скільки таких елементів може бути в кожному періоді періодичної системи? Чому? Тому що максимальна кількість електронів на d-підрівні – 10.
Завдання 14. Використовуючи періодичну систему хімічних елементів, наведіть приклади d-елементів.
У нижній частині таблиці окремо розташовані два ряди хімічних елементів, що називаються лантаноїди й актиноїди. В якому періоді вони мають розташовуватися? Скільки таких елементів у кожному періоді? Чому? Елементи лантаноїди й актиноїди відрізняються від решти хімічних елементів тим, що в них заповнюється електронами f-підрівень, максимальна кількість електронів на f-підрівні – 14, тому й f-елементів у кожному періоді – 14.
Завдання 15. Використовуючи періодичну систему хімічних елементів, наведіть приклади f-елементів.
IV. Підбиття підсумків уроку
1. Що нового ви дізналися сьогодні на уроці?
2. Чому в короткоперіодній формі періодичної системи є головні й побічні підгрупи? Чим відрізняються елементи, розташовані в головній і побічній підгрупах?
3. Яка максимальна кількість періодів може бути в періодичній системі?
4. Яка максимальна кількість груп може бути в періодичній системі? Чому?
5. Чому змінюються властивості хімічних елементів у періодах і групах?
V. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на запитання, виконати вправи.
