Теорія хімічної будови органічних сполук – ОСНОВНІ ПОЛОЖЕННЯ ОРГАНІЧНОЇ ХІМІЇ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина III. ОРГАНІЧНА ХІМІЯ
Розділ 15. ОСНОВНІ ПОЛОЖЕННЯ ОРГАНІЧНОЇ ХІМІЇ
§ 15.4. Теорія хімічної будови органічних сполук О. М. Бутлерова
Визначною подією у розвитку органічної хімії було створення у 60-х роках XIX ст. великим російським ученим О. М. Бутлеровим теорії хімічної будови органічних сполук. Ця теорія заклала наукові основи органічної хімії та пояснила її найважливіші закономірності. Основні принципи своєї теорії О. М. Бутлеров виклав у доповіді “Про теорію
Основні положення теорії будови полягають ось у чому.
1. У молекулах атоми сполучені один з одним у певній послідовності відповідно до їх валентності. Порядок зв’язку атомів називається хімічною будовою.
2. Властивості речовини залежать не лише від того, які атоми і в якій кількості входять до складу її молекули, а й від того, в якому порядку вони сполучені між собою, тобто від хімічної будови молекули.
3. Атоми або групи атомів, що утворили
Пояснимо ці положення. До О. М. Бутлерова вважалося неможливим пізнати будову молекули, тобто порядок хімічного зв’язку між атомами. Багато вчених навіть заперечували реальність атомів і молекул. О. М. Бутлеров спростував ці погляди. Він виходив з правильних матеріалістичних та філософських уявлень про реальність існування атомів і молекул, про можливість пізнання хімічного зв’язку атомів у молекулі. Він показав, що будову молекули можна встановити експериментально, вивчаючи хімічні перетворення речовини. І навпаки, знаючи будову молекули, можна вивести хімічні властивості сполуки.
Теорія хімічної будови враховує особливості елемента карбону (див. § 15.2). Вивчення будови органічних сполук залишається основним завданням органічної хімії і у наш час. Для цього крім хімічних широко застосовуються фізичні методи дослідження, такі, як спектроскопія, ядерний магнітний резонанс, мас-спектрометрія, визначення електричних моментів диполів, рентгено – та електронографія.
Наявність ізомерів (див. § 15.3) випливає з основних положень теорії будови органічних сполук. Великим успіхом O. М. Бутлерова було передбачення двох ізомерів бутану на основі теорії будови (у вуглеводнях, починаючи з бутану, можливий різний порядок сполучення атомів у молекулах). У 1867 р. О. М. Бутлеров синтезував передбачений ізомер, що блискуче підтверджувало правильність теорії будови. Це був ізобутан, який від нормального бутану відрізняється будовою молекули, хоча обидва мають емпіричну формулу С4Н10 :1
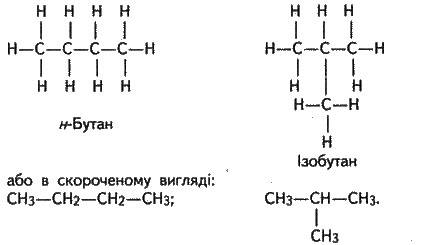
Отже, теорія хімічної будови пояснює різноманітність органічних сполук. Вона зумовлена здатністю чотиривалентного вуглецю утворювати вуглецеві ланцюги та кільця, сполучатися з атомами інших елементів, а також наявністю ізомерії.
В теорії хімічної будови велика увага приділяється Взаємному впливу атомів та груп атомів у молекулі. Він спостерігається у молекулі будь-якої речовини (органічної чи неорганічної). Пояснимо це на прикладі таких сполук: NaOH, Аl(OН)3, С2Н5ОН, NO2-ОН (нітратна кислота), SO2(OH)2 (сульфатна кислота). Всі вони містять гідроксильну групу (гідроксо – або оксигрупу) ОН. А втім, у водному розчині властивості речовин послідовно змінюються: NaOH – сильна основа,
Аl(OН)3 – амфотерний гідроксид, C2H5OH – практично нейтральна речовина, нітратна і сульфатна кислоти утворюють іони Н+. Причина різного хімічного характеру групи ОН зу мовлена впливом сполучених з нею атомів і груп. Зі зростанням неметапічних властивостей центрального атома послаблюється дисоціація за типом основи і зростає дисоціація за типом кислоти (в ряду Na, Аl, С2Н5, NO2, SO2) (див. також § 17.4).
Взаємно впливати один на одного можуть і атоми, безпосередньо не зв’язані між собою. Наприклад, різна реакційна здатність хлору в хлоретані СН3-СН2Сl і хлоретилені СН2=СН-Сl зумовлена різним впливом на атом хлору етильної (СН3-СН2-) та вінільної (СН2=СН-) груп. У молекулі хлоретану хлор досить реакційноздатний, у молекулі хлоретилену – інертний.
Велика заслуга у встановленні закономірностей взаємного впливу атомів у молекулі належить учню О. М. Бутлерова В. В. Марковникову.
Із сучасного погляду основні положення теорії будови потребують деякого доповнення – вказівок щодо просторової та електронної будови. Тоді у пункті 2 основних положень теорії будови слід підкреслити, що властивості органічних сполук визначаються складом їх молекул, а також їх хімічною, просторовою та електронною будовою.
Теорія хімічної будови О. М. Бутлерова є найважливішою частиною теоретичного фундаменту органічної хімії. За значенням її можна порівняти з періодичною системою елементів Д. І. Менделєєва. Подібно до останньої, вона дала змогу систематизувати величезний практичний матеріал, заздалегідь передбачити існування нових речовин, а також вказати шляхи їх добування. Це забезпечило небачені успіхи органічного синтезу. І у наш час теорія хімічної будови є керівною основою всіх досліджень з органічної хімії.
1Сполуки, що мають прямий вуглецевий ланцюг, прийнято називати нормальними, а ті, що мають розгалужений ланцюг, – ізосполуками. У прикладі: перший бутан – нормальної будови (н-бутан), другий бутан – ізобудови (ізобутан).
