Відносна атомна маса
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ
§ 1.4. Відносна атомна маса
Сучасні методи дослідження дають змогу визначити надзвичайно малі маси атомів з високою точністю. Наприклад, маса атома гідрогену становить 1,674 ∙ 10-27 кг, оксигену – 2,667 ∙ 10-26 кг, карбону – 1,993 ∙ 10-26 кг.
У хімії традиційно використовуються не абсолютні значення атомних мас, а відносні. У 1961 р. за одиницю атомної маси було прийнято атомну одиницю маси (скорочено а. о.
Більшість хімічних елементів містять атоми з різною масою (див. ізотопи, § 2.4). Тому відносною атомною масою Аr хімічного елемента називається величина, що дорівнює відношенню середньої маси атома природного ізотопічного складу елемента до 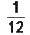 маси атома карбону 12С.
маси атома карбону 12С.
Відносні атомні маси1 елементів позначають Аr де індекс r – початкова буква англійського слова relative – “відносний”. Записи А(Н), А(O), А(С) означають: відносна атомна маса гідрогену, відносна атомна маса оксигену, відносна атомна маса карбону. Наприклад:
Відносна атомна маса – одна з основних характеристик хімічного елемента. Сучасні значення відносних атомних мас наведено в періодичній системі елементів Д. І. Менделєєва.
1 Замість терміна “відносна атомна маса” можна використовувати термін “атомна маса”, що виник історично.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- ВІДНОСНА АТОМНА МАСА – ХІМІЧНИЙ ЕЛЕМЕНТ Хімія – універсальний довідник ХІМІЧНИЙ ЕЛЕМЕНТ ВІДНОСНА АТОМНА МАСА У даний час за атомну одиницю маси (а. о. м.) взято 1/12 частину маси атома Карбону, а саме його ізотопу 12С. Вона складає 1,66 – 10 -24 г. У хімії застосовується безрозмірна величина – відносна атомна маса. Її можна знайти, порівнюючи маси атомів елементів з 1 […]...
- § 11. МАСА АТОМА. АТОМНА ОДИНИЦЯ МАСИ, ВІДНОСНІ АТОМНІ МАСИ ХІМІЧНИХ ЕЛЕМЕНТІВ № 1. Атомна одиниця маси (а. о. м.) – маса 1/12 частини атома Карбону, ядро якого складається з 6 протонів і 6 нейтронів. № 2, 3. Число, яке одержують діленням маси атома конкретного хімічного елемента на атомну одиницю маси (приблизно на 1,662 • 10-27 кг) має назву відносна атомна маса хімічного елемента й позначається Аr. […]...
- Відносна атомна маса, молекулярна маса, формульна маса ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина 1.6. Відносна атомна маса, молекулярна маса, формульна маса Теоретична хімія має справу з атомами і молекулами, і вираження їхньої маси у грамах для розрахунків є незручним. Так, абсолютна маса атома Гідрогену становить 1,673 ·10-24 г, атома Сульфуру – […]...
- Атомна маса Хімія Загальна хімія Основні поняття, закони й теорії хімії Атомна маса Абсолютні значення мас атомів елементів – дуже малі величини, і користуватися ними незручно. Тому в розрахунках застосовують відносні значення мас атомів. Атомною одиницею маси (а. о. м.) називається 1/12 частина маси атома Карбону. Відносною атомною масою називається число, що показує, у скільки разів маса […]...
- МАСА АТОМА. АТОМНА ОДИНИЦЯ МАСИ. ВІДНОСНІ АТОМНІ МАСИ ХІМІЧНИХ ЕЛЕМЕНТІВ Тема 1 ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ & 11. МАСА АТОМА. АТОМНА ОДИНИЦЯ МАСИ. ВІДНОСНІ АТОМНІ МАСИ ХІМІЧНИХ ЕЛЕМЕНТІВ Вивчення параграфа допоможе вам: · розрізняти поняття “маса атома”, “атомна одиниця маси”, “відносна атомна маса хімічного елемента”; · порівнювати масу атомів. МАСА АТОМА. Як ваді відомо з попереднього параграфи, атоми мають вражаюче малі розміри. Відповідно й маса атомів […]...
- Маса атома. Відносна атомна маса Розділ 1 Початкові хімічні поняття 10 Маса атома. Відносна атомна маса Матеріал параграфа допоможе вам: > з’ясувати відмінність між масою атома і відносною атомною масою; > порівнювати маси атомів. Маса атома. Важливою характеристикою атома є його маса. Майже вся маса атома зосереджена в ядрі. Електрони мають настільки малу масу, що нею зазвичай нехтують. Зважувати атоми […]...
- Атомна одиниця маси. Відносна атомна маса хімічних елементів Тема 1 ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ Урок 8 Тема. Атомна одиниця маси. Відносна атомна маса хімічних елементів Цілі уроку: розширити знання учнів про періодичну систему елементів; закріпити знання учнів про хімічний елемент, хімічну символіку; ознайомити учнів з поняттям абсолютної та відносної атомної маси, одиницею вимірювання відносної атомної маси – атомною одиницею маси (а. о. м.); навчити […]...
- Відносна атомна маса. Відносна молекулярна маса Контрольні запитання № 1. Відносна атомна маса – це відношення маси атома даного елемента до 1/12 маси атома Карбону. Відносна молекулярна маса М показує, у скільки разів маса молекули більша за 1/12 маси атома Карбону. Для речовин йонної будови хімічна формула відображає склад формульної одиниці. Тому для таких речовин використовують відносну формульну масу. № 2. […]...
- Відносна молекулярна маса ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ § 1.5. Відносна молекулярна маса Відносною молекулярною масою Мr речовини називається величина, що дорівнює відношенню середньої маси молекули природного ізотопічного складу речовини до маси атома карбону 12С. Відносна молекулярна маса чисельно дорівнює сумі відносних атомних […]...
- Поняття про періодичну систему хімічних елементів Д. І. Менделєєва. Атомна одиниця маси. Відносна атомна маса ТЕМА 1. ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ Урок 4. Поняття про періодичну систему хімічних елементів Д. І. Менделєєва. Атомна одиниця маси. Відносна атомна маса Цілі: ознайомитися з періодичною системою хімічних елементів і її будовою, навчитися розрізняти періоди і групи, визначати елементи за місцем у періодичній системі й місце елементів у ній; дати поняття “атомна одиниця маси” і […]...
- ВІДНОСНА МОЛЕКУЛЯРНА МАСА. МАСОВА ЧАСТКА ЕЛЕМЕНТА В СКЛАДНІЙ РЕЧОВИНІ № 1. Відносну молекулярну масу також визначають на основі порівняння маси молекули з масою 1/12 частини атома Карбону, ядро якого містить шість протонів і шість нейтронів, тобто з атомною одиницею маси. Відносна молекулярна маса речовини показує, у скільки разів маса молекули більша за атомну одиницю маси. Як і відносна атомна маса, відносна молекулярна маса є […]...
- Відносна молекулярна маса Розділ 1 Початкові хімічні поняття 15 Відносна молекулярна маса Матеріал параграфа допоможе вам: > з’ясувати, що таке відносна молекулярна маса; > навчитись обчислювати відносні молекулярні маси. Маси молекул, як і атомів, надзвичайно малі. Тому в хімії використовують відносні маси молекул. Їх зазвичай називають відносними молекулярними масами. Відносна молекулярна маса – це відношення маси молекули до […]...
- Відносна молекулярна маса речовини. Масова частка елемента в складній речовині Тема 1 Початкові хімічні поняття & 12. Відносна молекулярна маса речовини. Масова частка елемента в складній речовині Опанувавши цю тему, ви зможете: – розуміти поняття “відносна молекулярна маса”, “масова частка елемента в складній речовині”; – уміти обмислювати відносну молекулярну масу за формулами речовин, масову частку елемента в складній речовині; – формувати навички в обчисленнях за […]...
- Хімічні формули речовин. Відносна молекулярна маса, її обчислення за хімічними формулами ТЕМА 1. ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ Урок 11. Хімічні формули речовин. Відносна молекулярна маса, її обчислення за хімічними формулами Цілі: на основі знань про хімічні формули речовин вивчити, що таке відносна молекулярна маса речовини; навчитись обчислювати відносну молекулярну масу речовини за її формулою; розвивати знання учнів про хімічну формулу й уміння нею користуватися; розвивати логічне мислення; […]...
- ВІДНОСНА МОЛЕКУЛЯРНА МАСА. МАСОВА ЧАСТКА ЕЛЕМЕНТА В СКЛАДНІЙ РЕЧОВИНІ Тема 1 ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ & 16. ВІДНОСНА МОЛЕКУЛЯРНА МАСА. МАСОВА ЧАСТКА ЕЛЕМЕНТА В СКЛАДНІЙ РЕЧОВИНІ Вивчення параграфа допоможе вам: · обчислювати відносну молекулярну масу речовини за її формулою; · обчислювати масову частку елемента в складній речовині; · обчислювати відносну молекулярну масу сполуки за відомими масовими частками елементів Молекули, як і атоми, мають дуже малу […]...
- Відносні атомні маси хімічних елементів Тема 1 Початкові хімічні поняття & 7. Відносні атомні маси хімічних елементів Опанувавши цю тему, ви зможете: – розуміти кількісну характеристику атома; – розрізняти поняття “відносна атомна маса” і “маса атома”; – знати одиницю, щодо якої обчислюють відносні атомні маси елементів, а також першу класифікацію елементів на металічні й неметалічні; – уміти знаходити значення відносних […]...
- Моль. Молярна маса ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ § 1.6. Моль. Молярна маса У Міжнародній системі одиниць (Сl) за одиницю кількості речовини прийнято моль. Моль – це кількість речовини, що містить стільки структурних одиниць (молекул, атомів, іонів, електронів чи інших), скільки атомів міститься […]...
- Вправа 65-72 № 65. Маса атома – важлива характеристика атома. Відносна атомна маса – маса атома елемента в порівнянні з 1/12 масою атома Карбону. № 67. Запис Аr – відносна атомна маса (а. о. м), Аг – символ елементу Аргону. № 68. Be → Аг = 9. Al → Аr =27. Легший атом Берилію у 3 рази. […]...
- Відносна молекулярна маса речовини, її обчислення за хімічною формулою Тема 1 ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ Урок 15 Тема. Відносна молекулярна маса речовини, її обчислення за хімічною формулою Цілі: поглибити поняття про хімічну формулу, її використання для розрахунків; дати поняття про відносну молекулярну масу; формувати вміння й навички обчислювання за хімічними формулами; навчити визначати відносну молекулярну масу простих і складних речовин за їх формулами. Тип уроку: […]...
- ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА. СТРУКТУРА ПЕРІОДИЧНОЇ СИСТЕМИ № 1. У періодичній системі хімічні елементи розміщені в пронумерованих клітинках. Номер клітинки кожного хімічного елемента невипадковий – він дорівнює заряду ядра атома. Так заряд ядра атома Оксигену +8 і його порядковий номер теж 8. Кожний елемент у періодичній системі має свій порядковий номер. Він є цілим числом і в кожного наступного елемента збільшується на […]...
- Кількість речовини, молярна маса ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина 1.7. Кількість речовини, молярна маса Кількість речовини п (або V, ню) – це фізична величина, яка визначає кількість частинок (молекул, атомів, йонів, йонних угруповань – асоціатів) у певній її порції. Одиницею вимірювання кількості речовини є моль. Моль – […]...
- Молекулярна маса Хімія Загальна хімія Основні поняття, закони й теорії хімії Молекулярна маса Відносна молекулярна маса – число, що показує, у скільки разів маса даної молекули більша за 1/12 маси молекули вуглецю. Це безрозмірна величина, що позначається Mr. Відносну молекулярну масу обчислюють додаванням відносних атомних мас всіх елементів, що входять у молекулу, з урахуванням індексів. Наприклад: ; […]...
- МАСА АТОМІВ І МОЛЕКУЛ Фізика підготовка до ЗНО комплексне видання МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА 1. ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ 1.3. МАСА АТОМІВ І МОЛЕКУЛ Маси атомів і молекул прийнято порівнювати з 1/12 маси атома ізотопу Карбону 126С. Відносною молекулярною масою Мr називають відношення маси молекули mo до 1/12 маси атома Карбону m0с (атомної одиниці маси, а. о. м.): Де Мr […]...
- Основні фізичні величини, які використовують у хімії Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ ЗАКОНИ Й ПОНЯТТЯ ХІМІЇ Основні фізичні величини, які використовують у хімії У хімії використовують такі фізичні величини: маса, об’єм, кількість речовини, густина, атомна маса, відносна атомна й молекулярна маса, молярна маса, молярний об’єм, відносна густина газів, тиск, температура, час, концентрація, швидкість хімічної […]...
- Модель Дальтона БУДОВА АТОМА Згідно з уявленнями давньогрецьких вчених Левкіппа і Демокріта, матерія не може ділитися нескінченно. Має існувати найменша частинка, яка далі не ділиться, – атом (від грец. atomos – неподільний). Однак уявлення про будову атома відтоді дуже змінилося. 1. Модель Дальтона У 1803 році Джон Дальтон звернувся до античних уявлень. Його гіпотеза про атоми включала […]...
- ХІМІЧНІ СИМВОЛИ – ХІМІЧНИЙ ЕЛЕМЕНТ Хімія – універсальний довідник ХІМІЧНИЙ ЕЛЕМЕНТ ХІМІЧНІ СИМВОЛИ Усі назви хімічних елементів і їхні відповідні хімічні символи ви знайдете в таблиці, що є вираженням періодичного закону, відкритого великим російським хіміком Д. І. Менделєєвим у 1869 р. Вона містить усі відомі людині природні й отримані штучно хімічні елементи. У кожній клітинці таблиці, крім хімічного символу і […]...
- Склад атома Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ БУДОВА АТОМА Склад атома Атоми складаються з позитивно зарядженого ядра та електронів. Електрон – найлегший з відомих елементарних частинок. Його маса (9,1 ∙ 10-31 кг) У 1837 разів менша від маси найлегшого з атомів – атома Гідрогену. Електричний заряд електрона називають елементарним – […]...
- Валентність атомів елементів. Визначення валентності й складання хімічних формул за валентністю атомів елементів Хімія Загальна хімія Основні поняття, закони й теорії хімії Валентність атомів елементів. Визначення валентності й складання хімічних формул за валентністю атомів елементів Валентність – це властивість атомів хімічного елемента утворювати хімічні зв’язки з певним числом атомів інших хімічних елементів. За одиницю валентності прийнята валентність атома Гідрогену. Він одновалентний, тобто може утворювати тільки один зв’язок. Кількісне […]...
- ПЕРІОДИЧНА СИСТЕМА XIМІЧHИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА. СТРУКТУРА ПЕРІОДИЧНОЇ СИСТЕМИ Тема 1 ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ & 12. ПЕРІОДИЧНА СИСТЕМА XIМІЧHИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА. СТРУКТУРА ПЕРІОДИЧНОЇ СИСТЕМИ Вивчення параграфа допоможе вам: · ознайомитися зі структурою періодичної системи; · використовувати періодичну систему хімічних елементів як довідкову для визначення відносної атомної маси хімічних елементів. Ідея створення періодичної системи належить видатному російському хіміку Дмитру Івановичу Менделєєву й датована […]...
- АТОМНА ЕНЕРГІЯ Екологія – охорона природи АТОМНА ЕНЕРГІЯ – енергія, яка виробляється на атомних станціях за рахунок розщеплення атомних ядер елементів ядерного палива (переважно урану-235). Розщеплення атомних ядер відбувається в ядерному реакторі. В усьому світі переважають водо-водяні реактори, в яких вода виконує роль як теплоносія, так і сповільнювача. Тепло, що виділяється при розщепленні ядер, сприймається системою теплопередач […]...
- Тема 1. Атомно-молекулярна будова речовини – ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Тема 1. Атомно-молекулярна будова речовини Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Позначте визначення атома: A. Найменша частинка, що входить до складу молекули і зберігає її властивості; Б. Електронейтральна частинка речовини, що […]...
- Нукліди, ізотопи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 2. Будова атома 2.2. Нукліди, ізотопи Будь-який вид атомів, який характеризується певним масовим числом і атомним номером, називають нуклідом. Нині кількість відомих нуклідів елементів становить понад 2200. Для того щоб розрахувати кількість нейтронів у ядрі атома, потрібно від значення нуклонного числа відняти протонне […]...
- Тематичне оцінювання з теми “Атомна і ядерна фізика” 2-й семестр АТОМНА І ЯДЕРНА ФІЗИКА УРОК 16/93 Тема. Тематичне оцінювання з теми “Атомна і ядерна фізика” Мета уроку: контроль і оцінювання знань, умінь і навичок учнів з вивченої теми. Тип уроку: урок контролю й оцінювання знань. МЕТОДИЧНІ РЕКОМЕНДАЦІЇ Підсумкове тематичне оцінювання можна провести у вигляді контрольної роботи. Кожний варіант контрольної роботи містить шість задач. […]...
- Маса і розміри молекул. Кількість речовини ВЛАСТИВОСТІ ГАЗІВ, РІДИН, ТВЕРДИХ ТІЛ* Урок № 4 Тема. Маса і розміри молекул. Кількість речовини Мета: конкретизувати положення про масу молекул, відносну молекулярну масу, кількість речовин, молярну масу, число Авогадро. Обладнання: періодична система елементів Менделєєва. План уроку 1. Визначення маси молекул та її розмірів. 2. Для чого ввели відносну атомну масу речовин. 3. Поняття кількості […]...
- Основні фізико-хімічні величини – ХІМІЯ Формули й таблиці ХІМІЯ Основні фізико-хімічні величини № Назва Позначення Формула Одиниці вимірювання 1 Маса M – Кг(г) 2 Атомна одиниця маси А. о. м. 3 Відносна атомна маса Аr – 4 Відносна молекулярна маса Мr Де і – число атомів у молекулі – 5 Молярна маса М 6 Кількість речовини ν Моль 7 Стала […]...
- Кількісний аналіз – Визначення формули АНАЛІЗ ОРГАНІЧНИХ СПОЛУК 1.2. Кількісний аналіз Для кількісного аналізу речовини береться точно зважена кількість речовини і непрямим шляхом визначається маса елементів, зв’язаних у речовині. Якщо речовина складається тільки з Карбону, Гідрогену й Оксигену, то вона повністю окислюється повітрям або киснем і купрум оксидом до СО2 і Н2О. Вода абсорбується в ємкості, заповненій сухим кальцій хлоридом, […]...
- ОКСИГЕН ЯК ХІМІЧНИЙ ЕЛЕМЕНТ. ОКСИДИ – КИСЕНЬ Хімія – універсальний довідник КИСЕНЬ ОКСИГЕН ЯК ХІМІЧНИЙ ЕЛЕМЕНТ. ОКСИДИ Хімічний символ Оксигену – О. Його відносна атомна маса 15,9994 ≈ 16. Елемент О знаходиться в VIA групі періодичної системи, отже, можливі його валентності – вища 6 і нижча 2. Але правіше від Оксигену в таблиці розташований лише один елемент F, а вище – жодного. […]...
- Обчислення молекулярної маси речовини й масових часток елементів у ній ТЕМА 1. ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ Урок 13. Обчислення молекулярної маси речовини й масових часток елементів у ній Цілі: узагальнити знання учнів про зміст хімічної формули; розвивати вміння учнів обчислювати молекулярну масу речовини й масову частку елементів за хімічною формулою; виховувати прагнення працювати самостійно. Обладнання: періодична таблиця хімічних елементів Д. І. Менделєєва; дидактичний матеріал: картки із […]...
- Склад атома. Нуклон, протонне число, нуклонне число ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 2. Будова атома 2.1. Склад атома. Нуклон, протонне число, нуклонне число Одним з видів матерії є речовина, з якої утворюються прості й складні тіла. Складові частини цих тіл – атоми різноманітних хімічних елементів. Атом – це найменша частина хімічного елемента, яка зберігає всі […]...
- Електронегативність – Періодичний закон та теорія будови атома Хімія Загальна хімія Періодичний закон та теорія будови атома Електронегативність Електронегативність – здатність атома притягати до себе електрони інших атомів (маються на увазі валентні електрони зовнішнього енергетичного рівня). Звичайно за одиницю приймають електронегативність Літію і з нею порівнюють електронегативність інших елементів, одержуючи прості й зручні для порівняння значення відносної електронегативності елементіВ. Відносна електронегативність відповідає Періодичному […]...