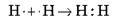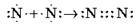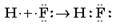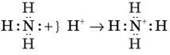Хімічний зв’язок, будова речовини
I СЕМЕСТР
ПОВТОРЕННЯ ОСНОВНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ (4 год.)
УРОК 2
Тема уроку. Хімічний зв’язок, будова речовини
Цілі уроку: актуалізувати знання учнів про природу хімічного зв’язку, види хімічного зв’язку; розвивати вміння використовувати теоретичні знання для прогнозування властивостей елементів та їхніх сполук на підставі знань про будову атома й будову речовини; розвивати навички складання молекулярних і структурних формул речовин, описувати властивості речовин на підставі знань про хімічний зв’язок.
Тип
Форми роботи: фронтальна, групова.
Обладнання: періодична система хімічних елементів, ряд активності металів, таблиця розчинності, схема до уроку 2.
ХІД УРОКУ
I. Організація класу
II. Актуалізація опорних знань учнів з теми “Хімічний зв’язок. Будова речовини”
1. Фронтальна бесіда за основними питаннями теми
(з використанням схеми 2)
Поясніть, як ви розумієте поняття “хімічний зв’язок”.
Хімічний зв’язок – це сила, що втримує разом певне число атомів, іонів, молекул.
Отже, це взаємодії, що приводять до об’єднання
Які зв’язки називаються міжмолекулярними?
Міжмолекулярні зв’язки – це зв’язки між молекулами. Це водневий зв’язок, іон-дипольний зв’язок (за рахунок утворення цього зв’язку відбувається, наприклад, утворення гідратної оболонки іонів), диполь-дипольний (за рахунок утворення цього зв’язку з’єднуються молекули полярних речовин, наприклад, у рідкому ацетоні) та ін.
Який зв’язок називається іонним?
Іонний зв’язок – це хімічний зв’язок, утворений за рахунок електростатичного притягання різнойменно заряджених іонів. У бінарних сполуках (сполуках з двох елементів) він утворюється у випадку, коли одні атоми легко віддають електрони, а інші схильні їх приймати (зазвичай це атоми елементів, що утворюють типові метали, а також атоми елементів, які утворюють типові неметали); електронегативність таких атомів значною мірою відрізняється (??> 2).
Іонний зв’язок є ненаправленим і ненасичуваним.
Поясніть механізм утворення ковалентного зв’язку.
Ковалентний зв’язок – це хімічний зв’язок, що виникає за рахунок перекривання електронних хмарин неспарених електронів. Ковалентний зв’язок утворюється між атомами з однаковою або близькою електронегативністю. Необхідна умова – наявність неспарених електронів в обох атомів, що зв’язуються (обмінний механізм), або неподіленої пари в одного атома й вільної орбіталі – у другого (донорно-акцепторний механізм):
А |
| H – H | H2 | Одна загальна пара електронів; H одновалентний |
Б |
|
| N2 | Три загальні пари електронів; N тривалентний |
В |
| H – F | HF | Одна загальна пара електронів; H і F одновалентні |
Г |
|
| NH4+ | Чотири загальні пари електронів; N чотиривалентний |
За характером перекривання електронних хмарин (“орбіталей”) ковалентний зв’язок поділяється на?-зв’язок і?-зв’язок. ?-зв’язок утворюється за рахунок прямого перекривання електронних хмарин (уздовж прямої, що з’єднує ядра атомів), ?-зв’язок – за рахунок бічного перекривання (по обидва боки від площини, у якій перебувають ядра атомів).
За кількістю загальних електронних пар ковалентні зв’язки поділяються на такі:
– прості (одинарні) – одна пара електронів (?-зв’язок);
– подвійні – дві пари електронів (?-зв’язок і?-зв’язок);
– потрійні – три пари електронів (?-зв’язок і два?-зв’язки).
Подвійні й потрійні зв’язки називаються кратними зв’язками.
Наведіть приклади сполук із кратними зв’язками.
За розподілом електронної густини між атомами, що зв’язуються, ковалентний зв’язок поділяється на неполярний і полярний. Неполярний зв’язок утворюється між однаковими атомами, полярний – між різними (?? > 2).
Що таке електронегативність?
Електронегативність – це міра здатності атома в речовині притягувати до себе загальні електронні пари.
Електронні пари полярних зв’язків зміщені в бік більш електронегативних елементів. Власне зсув електронних пар називається поляризацією зв’язку. Часткові (надлишкові) заряди, що утворюються в процесі поляризації, позначаються?+ і?-, наприклад: H?+ ^ F?-.
Ковалентний зв’язок має спрямованість і насичуваність, а також здатність поляризуватися.
Для пояснення і прогнозування взаємного напрямку ковалентних зв’язків використовують модель гібридизації.
Гібридизація атомних орбіталей і електронних хмар – це передбачуване вирівнювання атомних орбіталей за енергією, а електронних хмарин – за формою в процесі утворення атомом ковалентних зв’язків.
Найчастіше трапляються три типи гібридизації: sp-, sp2- і sp3-гiбридизація. Наприклад:
– sp-гібридизація – у молекулах C2H2, BeH2, CO2 (лінійна будова);
– sp2-гібридизація – у молекулах C2H4, C6H6, BF3 (пласка трикутна форма);
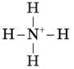
– sp3-гібридизація – у молекулах CCl4, SiH4, CH4 (тетраедрична форма); NH3 (пірамідальна форма); H2O (кутова форма).
Назвіть особливості металевого зв’язку.
Металевий зв’язок – це хімічний зв’язок, утворений за рахунок усуспільнення валентних електронів усіх атомів металевого кристала, що зв’язуються. У результаті утворюється єдина електронна хмарина кристала, що легко зміщається під дією електричної напруги, звідси – висока електропровідність металів.
Металевий зв’язок утворюється в тому випадку, коли атоми, що зв’язуються, великі й тому схильні віддавати електрони. Прості речовини з металевим зв’язком – метали (Na, Ba, Al, Cu, Au та ін.), складні речовини – інтерметалеві сполуки (AlCr2, Ca2Cu, Cu5Zn8 та ін.).
Металевий зв’язок не має спрямованості й насичуваності. Він зберігається й у розплавах металів.
Який зв’язок називається водневим?
Водневий зв’язок – це міжмолекулярний зв’язок, утворений за рахунок взаємодії високоелектронегативного атома й атома Гідрогену з більшим позитивним частковим зарядом. Утворюється в тих випадках, коли в одній молекулі є атом з неподіленою парою електронів і високою електронегативністю (F, O, N), а в іншій – атом Гідрогену, зв’язаний дуже полярним зв’язком з одним з таких атомів.
Наведіть приклади міжмолекулярних водневих зв’язків:
H – O – H… OH2
H – O – H… NH3
H – O – H… F – H
H – F… H – F
Внутрішньо-молекулярні водневі зв’язки існують у молекулах поліпептидів, нуклеїнових кислот, білків тощо.
Мірою міцності будь-якого зв’язку є енергія зв’язку.
Енергія зв’язку – це енергія, необхідна для розриву певного хімічного зв’язку в 1 моль речовини. Одиниця вимірювання – 1 кДж/моль.
Енергії іонного й ковалентного зв’язків – одного порядку, енергія водневого зв’язку – на порядок менша.
2. Будова речовини
На які групи за типом будови поділяються всі речовини?
На молекулярні й немолекулярні. Серед органічних речовин переважають молекулярні речовини, серед неорганічних – немолекулярні.
За типом хімічного зв’язку речовини поділяються на речовини з ковалентним зв’язком, речовини з іонним зв’язком (йонні речовини) та речовини з металевим зв’язком (метали).
Речовини з ковалентним зв’язком можуть бути молекулярними й немолекулярними. Це істотно позначається на їхніх фізичних властивостях.
Наведіть приклади речовин молекулярної будови.
Молекулярні речовини складаються з молекул, зв’язаних між собою слабкими міжмолекулярними зв’язками, наприклад: H2, O2, N2, Cl2, Br2, S8, P4 та інші прості речовини; CO2, SO2, N2O5, H2O, HCl, HF, NH3, CH4, C2H5OH, органічні полімери й багато інших речовин. Ці речовини не характеризуються високою міцністю, мають низькі температури плавлення й кипіння, не проводять електричного струму, деякі з них розчиняються у воді або інших розчинниках.
Які властивості мають речовини немолекулярної будови?
Немолекулярні речовини з ковалентними зв’язками, або атомні речовини (алмаз, графіт, Si, SiO2, SiC та ін.), утворюють дуже міцні кристали (виняток – шаруватий графіт), вони нерозчинні у воді та інших розчинниках, мають високі температури плавлення й кипіння, більшість із них не проводить електричного струму (крім графіту, що виокремлюється електропровідністю, і напівпровідників – силіцію, германію та ін.)
Охарактеризуйте фізичні властивості іонних речовин.
Усі іонні речовини – тверді тугоплавкі речовини, розчини й розплави яких проводять електричний струм. Багато які з них розчиняються у воді. Слід зазначити, що в іонних речовинах, кристали яких складаються зі складних іонів, наявні й ковалентні зв’язки, наприклад: (Na+)2(SO42-), (К+)3(PO43-), (NH4+)(NO3-) тощо. Ковалентними зв’язками пов’язані атоми, з яких складаються складні іони.
Наведіть приклади фізичних властивостей речовин з металевим зв’язком.
Метали (речовини з металевим зв’язком) дуже різноманітні за своїми фізичними властивостями.
Характерними фізичними властивостями металів є їхня висока електропровідність (на відміну від напівпровідників, зменшується з підвищенням температури), висока теплоємність і пластичність (у чистих металів).
У твердому стані майже всі речовини складаються з кристалів. За типом будови й типом хімічного зв’язку кристали (“кристалічні гратки”) поділяють на атомні (кристали немолекулярних речовин з ковалентним зв’язком), іонні (кристали іонних речовин), молекулярні (кристали молекулярних речовин з ковалентним зв’язком) і металеві (кристали речовин з металевим зв’язком).
III. Керована практика
На розсуд учителя й залежно від підготовленості класу завдання можна використовувати для фронтальної, групової або індивідуальної роботи.
Завдання 1. Наведіть приклади речовин, які мають іонну, атомну й молекулярну кристалічні гратки. Яка з цих речовин матиме найнижчу температуру плавлення, а яка – найвищу? Чому?
Завдання 2. Оксиген утворює хімічні зв’язки з Натрієм, Хлором, Нітрогеном і Цинком. Запишіть формули цих сполук, укажіть вид хімічного зв’язку й тип кристалічної гратки. Поясніть, який зв’язок буде найменш полярним.
Завдання 3. З огляду на положення Оксигену, Сульфуру й Селену в періодичній системі укажіть вид хімічного зв’язку й тип кристалічних граток у сполуках цих елементів з Гідрогеном. Поясніть, у якій з цих сполук зв’язок найменш полярний.
Завдання 4. Який з хімічних зв’язків є найбільш полярним?
H – Cl, H – Br, H – І, H – P, H – S.
Поясніть, чому. Укажіть вид хімічного зв’язку.
Завдання 5. Наведіть приклади речовин, у яких Флуор утворює іонний, ковалентні полярний та неполярний зв’язки, укажіть тип кристалічних граток у цих сполуках.
Завдання 6. Метал масою 4,5 г, що має ступінь окиснення в сполуках +3, прореагував із хлоридною кислотою. При цьому виділився водень об’ємом 5,6 л (н. у.). Назвіть метал.
Завдання 7. Деякий метал масою 1,22 г у результаті взаємодії з хлором утворює сполуку масою 4,75 г. Ступінь окиснення цього металу в хлориді +2. Назвіть метал.
Завдання 8. У результаті взаємодії деякого металу масою 0,92 г з хлором одержали хлорид металу масою 2,34 г. Назвіть метал, якщо його ступінь окиснення в хлориді дорівнює +1.
Завдання 9. У результаті взаємодії деякого металу з водою в процесі нагрівання утворився оксид зі ступенем окиснення металу +2. Маса оксиду, що утворився, дорівнює 16,2 г, утвореної води – 0,4 г. Визначте, який метал було взято для реакції з водою.
IV. Підбиття підсумків і висновки
Оцінюємо роботу учнів, оцінки виставляємо за бажанням учнів.
V. Домашнє завдання
Повторити теорію електролітичної дисоціації.
Додаток
Схема 2
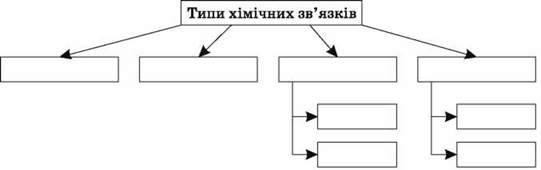
Ковалентний полярний (??) – ________________________________________________
Ковалентний неполярний (??) – ______________________________________________
Іонний (??) – ______________________________________________________________
Металевий (??) – __________________________________________________________
?-зв’язок – ________________________________________________________________
?-зв’язок – ________________________________________________________________
Типи гібридизації
Sp | Sp2 | Sp3 |
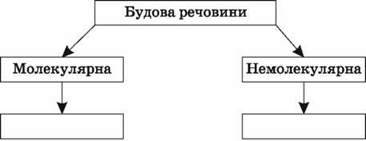
Типи кристалічних граток
Тип кристалічної гратки | Тип хімічного зв’язку | Фізичні властивості речовини | Приклади речовин |
Молекулярний | |||
Іонний | |||
Атомний | |||
Металевий |