Хромати і дихромати – МЕТАЛИ ПОБІЧНИХ ПІДГРУП
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП
§ 14.4. Хромати і дихромати
Хромові кислоти утворюють два ряди солей: хромати – так називаються солі хроматної кислоти – і дихромати – так називаються солі дихроматної кислоти. Хромати мають жовте забарвлення (колір хромат-іона Сr2-4 ), дихромати – оранжеве (колір дихромат-іона Сr2)2-7).
Іони СrО2-4 і Сr2О2-7 взаємно перетворюються при зміні концентрації іонів гідрогену за рівнянням:
2Сr2O2-4 + 2Н+ ⇆
І
Сr2O2-7 + 2OН ⇆ 2СrO24- + Н2О.
Звідси видно, що якщо підкиснити розчин, то рівновага буде зміщуватися в бік утворення дихромат-іонів Сr2О2-7, і навпаки, якщо добавляти луги, то рівновага буде зміщуватися в бік утворення хромат-іонів СrО2-. Так хромати можна перетворити на дихромати і навпаки.
Дихромати Na2Cr2O7 ∙ 2Н2О і К2Сr2О7 називаються хромпіками. Вони як окисники застосовуються у шкіряній (дублення шкір), лакофарбовій, сірниковій та текстильній ‘промисловості. Хромову суміш – так називають 3 %-вий розчин дихромату калію у концентрованій сульфатній кислоті – застосовують у хімічних лабораторіях
Солі хроматних кислот у кислому середовищі – сильні окисники. Наприклад:
+4 +6 +6 +3
3SO2 + К2Сr2О7 + H2SO4 = K2SO4 + Cr2(SO4)3 + Н2О;
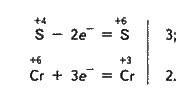
Сполуки хрому(ІІІ) у лужному середовищі відіграють роль відновників. Під дією різних окисників – Сl2, Вr2, Н2О2, КМnO4 тощо – вони переходять у сполуки хрому(ІV) – хромати:
+3 0 +6 -1
2Na + 3Br2 + 4NaOH = 2Na2CrO4 + 6NaBr + 8H2O;
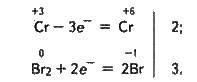
Тут сполука Сr(ІІІ) зображена у формі Na, оскільки у вигляді іонів Na і – вона міститься в надлишку розчину лугу.
Сильні окисники, такі, як KMnO4, (NH4)2S2O8, у кислому середовищі переводять сполуки Сr(ІІІ) у дихромати:
+3 +7 +6 +4
Cr2(SO4)3 + 2КМnO4 + 7Н2О = К2Сr2О7 + 2Мn(ОН)4 + 3H2SO4;
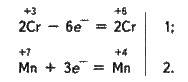
Отже, окисні властивості послідовно зростають зі зміною
+2 +3 +6
Ступенів окиснення в ряду: Сr -> Сr -> Сr. Сполуки Сr(ІІ) – сильні відновники, легко окиснюються, перетворюючись на сполуки хрому(ІІІ). Сполуки хрому(VІ) – сильні окисники, легко відновлюються до сполук хрому(ІІІ). Сполуки з проміжним ступенем окиснення, тобто сполуки хрому(ІІІ), можуть при взаємодії з сильними відновниками виявляти окисні властивості, переходячи у сполуки хрому(ІІ), а при взаємодії з сильними окисниками (наприклад, бромом, КМnO4) виявляти відновні властивості, перетворюючись на сполуки xpoMy(VI).
Солі хрому(ІІІ) дуже різноманітні за забарвленням: фіолетові, сині, зелені, коричневі, оранжеві, червоні та чорні. Усі хроматні кислоти та їх солі, а також оксид хрому(VІ) отруйні: уражають шкіру, дихальні шляхи, викликають запалення очей, тому, працюючи з ними, необхідно дотримувати усіх запобіжних заходів.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Оксиди та гідроксиди хрому – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.3. Оксиди та гідроксиди хрому Хром утворює три оксиди: СrО, Сr2О3 та СrО3. Оксид хрому(ІІ) СrО – пірофорний чорний порошок (пірофорність – здатність в тонкоподрібненому стані займатися на повітрі). Добувають його окисненням амальгами хрому киснем повітря. […]...
- Загальна характеристика підгрупи хрому – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.1. Загальна характеристика підгрупи хрому До металів побічних підгруп періодичної системи Д. І. Менделєєва належать всі d-елементи. Таких підгруп 10: скандію, титану, ванадію, хрому, мангану, феруму, кобальту, ніколу, купруму та цинку. Тут розглядаються загальні характеристики підгрупи […]...
- Хром – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.2. Хром Поширення у природі. Хром трапляється у вигляді сполук у різних мінералах. Найпоширеніший мінерал хроміт, або хромистий залізняк FeCr2O4, багаті родовища якого є на Уралі і в Казахстані. Загальний вміст хрому в земній корі становить […]...
- Розв’язування типових задач Метали та сплави – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП §14.10. Розв’язування типових задач Метали та сплави Задача 1. Відновлюючи вугіллям сполуку Fe(CrO2)2 (хромистий залізняк), добувають сплав ферохром, який використовують у металургії. Визначте масову частку хрому в цьому сплаві, вважаючи, що інших компонентів, крім феруму та хрому, […]...
- Сполуки заліза – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.7. Сполуки заліза Для заліза найбільш характерні два ряди сполук: сполуки феруму(ІІ) і феруму(ІІІ). Відома також незначна кількість сполук феруму(VІ) – ферати, наприклад ферат калію K3FeO4, ферат барію BaFeO4. Оксид ферум у (II) FeO – чорний […]...
- Залізо – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14. 6 . Залізо Найважливіші руди заліза. Залізо після алюмінію – найпоширеніший у природі метал. Загальний вміст його в земній корі становить 5,1 %. Залізо входить до складу багатьох мінералів. Найважливішими залізними рудами є: 1) магнітний […]...
- Загальна характеристика родини заліза – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.5. Загальна характеристика родини заліза У побічній підгрупі VIII групи періодичної системи елементів Д. І. Менделєєва розташовано 9 елементів: ферум, кобальт, нікол, рутеній, родій, паладій, осмій, іридій, платина. Подібні між собою елементи цієї групи утворюють горизонтальні […]...
- Доменний процес – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.8. Доменний процес Добування заліза з руд грунтується на відновленні його оксидів оксидом карбону(ІІ) та вугіллям (коксом). При цьому утворюється не чисте залізо, а сплав його з вугіллям та іншими домішками (кремнієм, марганцем, сіркою, фосфором). Цей […]...
- Чавун і сталі – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.9. Чавун і сталі Виплавлений у домні чавун містить феруму близько 93 %, карбону до 4,5 %, силіцію 0,5-2 %, мангану 1-3 %, фосфору 0,02-2,5 % і сульфуру 0,005-0,08 %. Чавун крихкий, не піддається куванню і […]...
- Оксид та гідроксид алюмінію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.12. Оксид та гідроксид алюмінію Оксид алюмінію (глинозем) Аl2О3 – речовина білого кольору, досить тугоплавка, з дуже високою твердістю. Є вихідним продуктом для добування алюмінію. У природі трапляється у вигляді корунду та його різновидів. Якщо безбарвні […]...
- Солі натрію і калію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.4. Солі натрію і калію Натрій утворює солі з усіма кислотами. Майже всі його солі розчинні у воді. Найважливіші з них – хлорид натрію (кухонна сіль), сода і сульфат натрію. Хлорид натрію NaCl – необхідна приправа […]...
- Загальна характеристика підгрупи літію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.1. Загальна характеристика підгрупи літію Підгрупу літію складають елементи: літій, натрій, калій, рубідій, цезій та францій. Деякі властивості цих елементів наведено в табл. 13.1. Це s-елементи (див. табл. 13.1, п. 2). Атоми на зовнішньому енергетичному рівні […]...
- Загальна характеристика підгрупи бору – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.10. Загальна характеристика підгрупи бору Головну підгрупу III групи (підгрупу бору) складають елементи бор, алюміній, галій, індій і талій. Деякі властивості цих елементів наведено у табл. 13.3. Таблиця 13.3. Властивості елементів підгрупи бору Властивості В АІ […]...
- Натрій і калій – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.2. Натрій і калій Поширення в природі. В природі лужні метали у вільному стані не трапляються. Натрій і калій входять до складу різних сполук. Найважливішою є сполука натрію з хлором NaCl, яка утворює поклади кам’яної солі […]...
- Застосування алюмінію та його сплавів – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.13. Застосування алюмінію та його сплавів Фізичні та хімічні властивості алюмінію зумовили його широке застосування в техніці. Значним споживачем алюмінію є авіаційна промисловість: літак на складається з алюмінію та його сплавів, а авіацшнии двигун – на […]...
- Загальна характеристика підгрупи берилію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.5. Загальна характеристика підгрупи берилію Цю підгрупу складають берилій, магній і лужноземельні елементи (кальцій, стронцій, барій, радій). Деякі властивості цих елементів наведено в табл. 13.2. Таблиця 13.2. Властивості елементів підгрупи берилію Властивості Be Mg Са Sr […]...
- Солі кальцію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.8. Солі кальцію Карбонат кальцію широко розповсюджений в природі у вигляді гірської породи – вапняку. Багато гірських хребтів складаються з вапняку і крейди. Часто трапляється і мармур, що утворився у давні геологічні епохи з вапняку і […]...
- Твердість води та способи її усунення – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.9. Твердість води та способи її усунення У природі чистої води не буває: вона завжди містить домішки яких-небудь речовин. Зокрема, взаємодіючи із солями, що містяться в земній корі, вона набуває певної твердості. Твердість води – сукупність […]...
- Їдкі луги – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.3. Їдкі луги Їдкими лугами називаються добре розчинні у воді гідроксиди. Найважливіші з них NaOH та КОН. Гідроксид натрію і гідроксид калію – білі, непрозорі, тверді кристалічні речовини. У воді добре розчиняються з виділенням великої кількості […]...
- Кальцій – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.6. Кальцій Поширення у природі. Кальцій належить до поширених елементів. Загальний вміст його в земній корі становить 3,6 %. У природі найбільш розповсюджені такі сполуки кальцію: мінерал кальцит СаСО3 (з нього утворені масиви вапняку, мармуру і […]...
- ФЕРУМ ЯК ПРЕДСТАВНИК МЕТАЛІЧНИХ ЕЛЕМЕНТІВ ПОБІЧНИХ ПІДГРУП. ФІЗИЧНІ Й ХІМІЧНІ ВЛАСТИВОСТІ ЗАЛІЗА, СПОЛУКИ ФЕРУМУ(ІІ) ТА ФЕРУМУ(ІІІ) ТЕМА 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ УРОК 13. ФЕРУМ ЯК ПРЕДСТАВНИК МЕТАЛІЧНИХ ЕЛЕМЕНТІВ ПОБІЧНИХ ПІДГРУП. ФІЗИЧНІ Й ХІМІЧНІ ВЛАСТИВОСТІ ЗАЛІЗА, СПОЛУКИ ФЕРУМУ(ІІ) ТА ФЕРУМУ(ІІІ) Цілі: повторити положення в ПС, будову атома Феруму, способи добування, фізичні властивості сполук Феруму(ІІ) та Феруму(ІІІ); вміти складати рівняння хімічних реакцій, що ілюструють хімічні властивості заліза, якісне визначення сполук Феруму(ІІ) […]...
- Алюміній – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.11. Алюміній Природні сполуки алюмінію. Алюміній належить до найпоширеніших елементів. Серед металів за поширенням у природі він посідає перше місце. Загальний вміст алюмінію в земній корі становить 8,8 %. Найважливіші природні сполуки алюмінію – алюмосилікати, боксит, […]...
- Елементи головних і побічних підгруп – Періодична система елементів і хвильова модель БУДОВА АТОМА 6 . Хвильова модель 6.3 . Періодична система елементів І хвильова модель Порядок розташування елементів у періодичній системі можна пояснити на основі принципу заповнення орбіталей. Електронну конфігурацію будь-якого елемента можна вивести, виходячи із трьох принципів, що знаходяться в тісному зв’язку з урахуванням квантових чисел. – Рівні з меншою енергією заповнюються в першу чергу […]...
- Оксид і гідроксид кальцію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.7. Оксид і гідроксид кальцію Оксид кальцію (технічні назви: негашене вапно, палене вапно, кипілка) – порошок білого кольору. У промисловості його добувають випалюванням вапняку, крейди чи інших карбонатних порід: СаСО3 = СаО + СО3; ∆Н° = […]...
- Тема 17. Загальні відомості про метали Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ НЕОРГАНІЧНА ХІМІЯ Тема 17. Загальні відомості про метали Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Установіть послідовність зростання металічних властивостей елементів: A. Аргентум; Б. Стронцій; B. Йод; Г. Станум. 2. Позначте твердження, що характеризує більшість металів за звичайних умов: […]...
- Метали в природі – Метали Хімія Неорганічна хімія Метали Метали в природі У природі метали існують переважно у вигляді сполук: оксидів, сульфідів, сульфатів, хлоридів, карбонатів і т. д. У вільному стані в земній корі зустрічаються найменш активні метали – золото, платина. Мідь, ртуть, срібло, олово можуть траплятися як у саморідному стані, так і в складі сполук. Мінерали й гірські породи, […]...
- Метали та сплави в техніці – ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 12. ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ § 12.4. Метали та сплави в техніці Сплавами називаються системи, що складаються з двох і більше металів, а також металів і неметалів. Властивості сплавів дуже різноманітні і відрізняються від властивостей вихідних компонентів. Так, наприклад, сплав, що складається […]...
- Солі нітратної кислоти – ПІДГРУПА НІТРОГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 10. ПІДГРУПА НІТРОГЕНУ § 10.9. Солі нітратної кислоти Одноосновна нітратна кислота утворює тільки середні солі, які називаються нітратами. Вони утворюються при дії кислоти на метали, їх оксиди і гідроксиди. Нітрати натрію, калію, амонію і кальцію називаються селітрами. NaNO3 – натрієва селітра, […]...
- Найважливіші окисники і відновники – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.2. Найважливіші окисники і відновники Відновники і окисники можуть бути як простими речовинами, тобто такими, що складаються з одного елемента, так і складними. Відповідно до їх місця в періодичній системі елементів атоми більшості металів містять на […]...
- Дисоціація кислот, основ і солей у водних розчинах – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.8. Дисоціація кислот, основ і солей у водних розчинах За допомогою теорії електролітичної дисоціації дають означення й описують властивості кислот, основ і солей. Кислотами називаються електроліти, під час дисоціації яких як катіони утворюються тільки катіони […]...
- Сильні кислоти й основи – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Силу кислоти або основи, за Бренстедом, визначають здатністю до протолізу, що залежить від того, як сильно виражена готовність речовини віддавати або приймати протони. Реагент визначає, яку функцію – кислоти чи основи – виконує речовина в реакції. У цьому випадку важливим реагентом є вода, оскільки […]...
- Сплави – Метали Хімія Неорганічна хімія Метали Сплави Сплави – це суміші, що складаються з двох або більше металів, а також металів і неметалів. Хімічний зв’язок у сплавах – металічний. Тому вони мають усі властивості металів. Властивості сплавів відрізняються від властивостей вихідних металів. Сплави добувають, змішуючи розплавлені метали, які потім охолоджуються й тверднуть. Повністю однорідні сплави – тверді […]...
- Солі сульфатної кислоти – ПІДГРУПА ОКСИГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 9. ПІДГРУПА ОКСИГЕНУ § 9.8. Солі сульфатної кислоти Сульфатна кислота, як двохосновна, утворює два ряди солей: середні, що називаються сульфатами, і кислі, що називаються гідросульфатами. Сульфати утворюються при повній нейтралізації кислоти лугом (на один моль кислоти припадає два молі лугу), а […]...
- КАРБОНАТНА КИСЛОТА ТА ЇЇ СОЛІ – ВУГЛЕЦЬ І ЙОГО СПОЛУКИ Хімія – універсальний довідник ВУГЛЕЦЬ І ЙОГО СПОЛУКИ КАРБОНАТНА КИСЛОТА ТА ЇЇ СОЛІ З хімічної точки зору оксид карбону (IV) – кислотний оксид із властивостями, характерними для даного класу неорганічних сполук. Йому відповідає карбонатна кислота Н2СО3. Це дуже нестійка сполука, у вільному вигляді не існує, та й у водних розчинах молекули карбонатної кислоти не виявляються. […]...
- Оцтова кислота – КИСНЕВМІСНІ ОРГАНІЧНІ СПОЛУКИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина III. ОРГАНІЧНА ХІМІЯ Розділ 17. КИСНЕВМІСНІ ОРГАНІЧНІ СПОЛУКИ § 17.12. Оцтова кислота Оцтова кислота при звичайній температурі – безбарвна рідина з різким характерним запахом. При температурі, нижчій за +16,6 °С, вона твердне у вигляді кристалів, схожих на лід, внаслідок чого дістала назву льодяної оцтової кислоти. […]...
- Фізичні властивості металів – Метали Хімія Неорганічна хімія Метали Фізичні властивості металів Пластичність. Механічна дія на кристал із металічним зв’язком викликає зсув шарів атомів, але завдяки переміщенню валентних електронів по всьому зразку металу розриву зв’язків не відбувається. Найпластичніший метал – золото. Марганець і бісмут – крихкі метали. Металічний блиск, непрозорість. Вільні електрони взаємодіють із квантами світла, які падають на метал. […]...
- Сильні й слабкі електроліти – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.10. Сильні й слабкі електроліти Розрізняють сильні й слабкі електроліти. Сильні електроліти під час розчинення у воді повністю дисоціюють на іони. До них належать: 1) майже всі солі; 2) багато мінеральних кислот, наприклад H2SO4, HNO3, […]...
- Корозія металів – Метали Хімія Неорганічна хімія Метали Корозія металів Корозія – руйнування металу під дією навколишнього середовища. Це окисно-відновний процес. Хімічна корозія – руйнування металу під час його окиснення без виникнення електричного струму в системі. При цьому метал взаємодіє з газами (газова корозія) і рідкими неелектролітами (бензин, нафта, толуол та ін.). Наприклад, сполука металів із киснем повітря. Електрохімічна […]...
- СОЛІ ЯК ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ СОЛІ ЯК ЕЛЕКТРОЛІТИ При розчиненні у воді солі дисоціюють з утворенням позитивно заряджених іонів металу (або амонію NН4+) і негативно заряджених кислотних залишків. Ці іони і визначають поведінку солей у розчинах. Солі можуть взаємодіяти з кислотами: З лугами: З іншими солями: І тут, як і в усіх реакціях, які відбуваються […]...
- Кальцій. Кальцій гідроксид і кальцій оксид – Метали Хімія Неорганічна хімія Метали Кальцій. Кальцій гідроксид і кальцій оксид Кальцій Кальцій Розташований у IIА групі (II групі, головній підгрупі), 4 періоді Періодичної системи. Він належить до лужноземельних металів. Електронна конфігурація атома Кальцію: На зовнішньому енергетичному рівні розміщені два електрони; ступінь окиснення Кальцію в сполуках +2. У вільному вигляді Кальцій у природі не зустрічається, поширений […]...