Ядерна модель будови атомів
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ
§ 2.3. Ядерна модель будови атомів
До кінця XIX ст. атоми вважалися неподільними. Потім, з нагромадженням експериментальних даних, довелося відмовитися від такого погляду і визнати, що атоми мають складну будову. Новий погляд підтверджувався періодичним законом Д. І. Менделєєва. Ще в 1871 р. Д. І. Менделєєв писав: “Легко припустити, що нині поки що нема можливості довести…, що атоми простих
На основі періодичного закону Д. І. Менделєєва, експериментальних досліджень і особливо явищ радіоактивності швидко розвивалося вчення про будову атомів і молекул.
Для вивчення будови атомів англійський учений Е. Резерфорд використав велику проникну здатність а-частинок. Він спостерігав проходження а-частинок (ядер гелію) крізь тонкі металеві пластинки завтовшки близько 10 000 атомів. Під час удару об екран, який покритий шаром сульфіду цинку
1 Менделеев Д. И. Избранные сочинения. – Я: Госхимиздат, 1934. – Т. II. – С. 111.
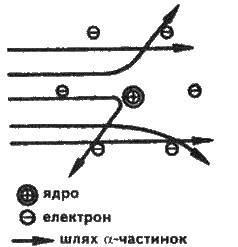
Рис. 2.1. Розсіювання а-частинок, що наближаються до атомного ядра
Е. Резерфорд пояснив розсіювання а-частинок, запропонувавши в 1911 р. ядерну модель будови атома. Згідно з цією моделлю атом складається з масивного позитивно зарядженого ядра, дуже малого за розмірами.
В ядрі сконцентрована майже все маса атома. Навколо ядра на значній відстані від нього обертаються електрони, які утворюють електронну оболонку атома.
Розмір усього атома близько 10-8 см, ядра – близько 10-8 см, тобто за розміром ядро приблизно в 100 000 разів менше за атом. Тому більшість а-частинок пролітають крізь атоми металевої пластинки на порівняно великих відстанях від їх ядер і не відхиляються від свого шляху. Однак окремі а-частинки проходять близько від ядер, внаслідок чого виникають кулонівські сили відштовхування, і частинки відхиляються. Ті частинки, які наближаються на достатньо малі відстані до ядра, відхиляються ще більш різко під дією тих самих сил (див. рис. 2.1).
Ядерна модель атома збереглась і в сучасних уявленнях.
Оскільки атом у цілому електронейтральний, то сумарний заряд електронів має дорівнювати заряду ядра. Подальші дослідження показали, що позитивний заряд ядра атома чисельно дорівнює порядковому номеру елемента в періодичній системі Д. І. Менделєєва.
Отже, число позитивних зарядів ядра кожного атома, а також число електронів, які обертаються в полі ядра, дорівнюють порядковому номеру елемента.
Найпростішою є схема будови атома гідрогену (порядковий номер дорівнює 1). Його ядро має один елементарний позитивний заряд, і в полі ядра обертається один електрон.
Ядро атома гідрогену – елементарна частинка, яку називають протоном.
Порядковий номер атома титану дорівнює 22. Отже, його позитивний заряд дорівнює 22, і в полі ядра обертаються 22 електрони. У 107-го елемента з позитивним зарядом ядра, що дорівнює 107, у полі ядра обертаються 107 електронів. Аналогічно можна уявити будову атомів й інших елементів.
