Загальна характеристика – Урок 2 – Металічні елементи головної підгрупи II групи
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
8. Металічні елементи та їхні сполуки. Метали
8.3. Металічні елементи головної підгрупи II групи1
8.3.1. Загальна характеристика
Лужноземельні металічні елементи – це s-елементи, які розміщуються у головній підгрупі II групи періодичної системи, а саме: Кальцій (Са), Стронцій (Sr), Барій (Ва), Радій (Ra). Інші елементи головної підгрупи – це Берилій (Be) та Магній (Mg).
Електронна формула – ns2, у збудженому стані – ns1np1. Зі збільшенням
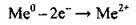
Хімічна активність елементів НА групи зростає зі збільшенням радіуса атома (від Берилію до Радію), і, відповідно, посилюються металічні властивості.
Прості
Усі лужноземельні метали мають сріблясто-білий колір, вони легкі, м’які, легкоплавкі, розрізаються ножем, мають хорошу електропровідність. На повітрі вкриваються шаром, який поряд з оксидами МеО містить пероксиди МеО2 і нітриди Me3N2. Через легкість окиснення на повітрі лужноземельні метали зберігають під шаром гасу.
Берилій утворює оксид і гідроксид, які мають амфотерні властивості. Усі інші елементи утворюють оксиди МеО та гідроксиди Ме(ОН)2, які виявляють основні властивості, що посилюються зі збільшенням порядкового номера елемента. Усі основи, крім Mg(OH)2 та Ве(ОН)2,- луги. Магній гідроксид розчиняється лише у гарячій воді; одержаний гідроксид при нагріванні взаємодіє з кислотними оксидами.
Леткі сполуки лужноземельних металічних елементів забарвлюють безбарвне полум’я в характерні кольори; сполуки Кальцію – у цегляно-червоний колір, Стронцію і Радію – у кармінно-червоний, Барію – у жовто-зелений.
___________________________________________________________
1 За новою номенклатурою – II групи.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Загальна характеристика – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.1. Загальна характеристика Лужні металічні елементи – це s-елементи, які розміщуються у головній підгрупі І групи періодичної системи: Літій (Li), Натрій (Na), Калій (К), Рубідій (Rb), Цезій (Cs) та Францій […]...
- Кальцій гідроксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.7. Кальцій гідроксид Кальцій гідроксид (Са(ОН)2). Насичений водний розчин кальцій гідроксиду називають вапняною водою, а білу суспензію кальцій гідроксиду – вапняним молоком. Одержання кальцій гідроксиду У лабораторії Са(ОН)2 одержують […]...
- Магній гідроксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.4. Магній гідроксид Магній гідроксид – нерозчинна у воді речовина білого кольору. При нагріванні розкладається: Взаємодіє: – з кислотними оксидами: – з кислотами (легко): – з амфотерними оксидами (при […]...
- Магній оксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.3. Магній оксид Магній оксид MgO – основний оксид. З водою не реагує, взаємодіє: – з кислотними оксидами (при нагріванні): – з кислотами: – із солями, витісняючи менш активні […]...
- Кальцій – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.5. Кальцій Кальцій – 20-й елемент періодичної таблиці, заряд ядра – +20. Хімічний символ – Са. Відносна атомна маса – 40. Утворює просту речовину – сріблясто-білий метал кальцій. Виявляє […]...
- Кальцій оксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.6. Кальцій оксид Кальцій оксид СаО має технічні назви палене вапно, негашене вапно. Кальцій оксид – сполука з яскраво вираженими основними властивостями. Добування кальцій оксиду У лабораторії: А) окисненням […]...
- Магній – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.2. Магній Магній – 12-й елемент періодичної таблиці, заряд ядра – +12. Хімічний символ – Mg, відносна атомна маса – 24. Відомо три стабільні природні ізотопи Магнію: 24Mg (78,6 […]...
- Солі кальцію – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.8. Солі кальцію Якісне виявлення: іони Са2+ забарвлюють полум’я газового пальника в цегляно-червоний колір. Карбонат амонію осаджує з розчинів солей Кальцію білий осад СаСО3. Гіпс CaSО4 · 2Н2О при […]...
- Загальна характеристика – Урок 5 – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.1. Загальна характеристика До складу головної підгрупи IV групи (14 групи) входять Карбон (С), Силіцій (Si), Германій (Ge), Станум (Sn) і Плюмбум (Рb). Будова зовнішнього електронного шару елементів – ns2nр2. Це p-елементи: […]...
- Загальна характеристика – Урок 3 – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.1. Загальна характеристика До складу головної підгрупи VI групи1 належать Оксиген, Сульфур, Селен, Телур і Полоній. Елементи цієї підгрупи ще називають халькогенами2, або елементами підгрупи Оксигену. Це p-елементи; будова зовнішнього електронного рівня […]...
- Загальна характеристика – Урок 4 – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.1. Загальна характеристика До складу головної підгрупи V групи1 входять Нітроген N, Фосфор Р, Арсен As, Стибій Sb і Вісмут Ві. Будова зовнішнього електронного шару елементів – ns’2np3. Це p-елементи: Валентність Нітрогену […]...
- Твердість води – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.9. Твердість води Твердість води зумовлена наявністю розчинних у ній солей. При використанні твердої води витрачається значно більше мийних засобів, утворюється накип на посуді та нагрівальних приладах. Дуже м’яка […]...
- Загальна характеристика підгрупи берилію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.5. Загальна характеристика підгрупи берилію Цю підгрупу складають берилій, магній і лужноземельні елементи (кальцій, стронцій, барій, радій). Деякі властивості цих елементів наведено в табл. 13.2. Таблиця 13.2. Властивості елементів підгрупи берилію Властивості Be Mg Са Sr […]...
- Загальна характеристика підгрупи бору – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.10. Загальна характеристика підгрупи бору Головну підгрупу III групи (підгрупу бору) складають елементи бор, алюміній, галій, індій і талій. Деякі властивості цих елементів наведено у табл. 13.3. Таблиця 13.3. Властивості елементів підгрупи бору Властивості В АІ […]...
- Оксиди і гідроксиди Натрію та Калію – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.3. Оксиди і гідроксиди Натрію та Калію Оксиди Натрію та Калію – це тверді білі речовини, які виявляють основні властивості, реагуючи – з водою (утворюються луги): – з кислотами: – […]...
- Електронна будова атомів металічних елементів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали Металічних елементів більше, ніж неметалічних: зі 118 відомих на початок 2012 р. елементів понад 90 – металічні. Усі металічні елементи утворюють прості речовини – метали. 8.1.1. Електронна будова […]...
- Калійні добрива – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.4. Калійні добрива Грунт – це верхній природний шар земної кори, основною характеристикою якого є родючість. Вона визначається багатьма факторами, зокрема вологістю та наявністю біогенних елементів2 – Нітрогену (30-50 мг/кг), […]...
- ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІЧНИХ ЕЛЕМЕНТІВ ЗА ЇХ ПОЛОЖЕННЯМ У ПЕРІОДИЧНІЙ СИСТЕМІ Й БУДОВОЮ АТОМІВ. МЕТАЛИ ЯК ПРОСТІ РЕЧОВИНИ. МЕТАЛІЧНИЙ ЗВ’ЯЗОК, МЕТАЛІЧНІ КРИСТАЛІЧНІ ГРАТКИ ТЕМА 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ УРОК 1. ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІЧНИХ ЕЛЕМЕНТІВ ЗА ЇХ ПОЛОЖЕННЯМ У ПЕРІОДИЧНІЙ СИСТЕМІ Й БУДОВОЮ АТОМІВ. МЕТАЛИ ЯК ПРОСТІ РЕЧОВИНИ. МЕТАЛІЧНИЙ ЗВ’ЯЗОК, МЕТАЛІЧНІ КРИСТАЛІЧНІ ГРАТКИ Цілі: на основі знань про періодичну систему елементів і будову атома дати загальну характеристику металічних елементів за їх положенням у періодичній системі й будовою […]...
- Загальна характеристика підгрупи літію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.1. Загальна характеристика підгрупи літію Підгрупу літію складають елементи: літій, натрій, калій, рубідій, цезій та францій. Деякі властивості цих елементів наведено в табл. 13.1. Це s-елементи (див. табл. 13.1, п. 2). Атоми на зовнішньому енергетичному рівні […]...
- Натрій і Калій – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.2. Натрій і Калій Натрій – 11-й елемент періодичної таблиці, заряд ядра – +11. Хімічний символ – Na. Природний Натрій складається з одного стабільного ізотопу – 23Na; відомо також 6 […]...
- Загальна характеристика підгрупи хрому – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.1. Загальна характеристика підгрупи хрому До металів побічних підгруп періодичної системи Д. І. Менделєєва належать всі d-елементи. Таких підгруп 10: скандію, титану, ванадію, хрому, мангану, феруму, кобальту, ніколу, купруму та цинку. Тут розглядаються загальні характеристики підгрупи […]...
- Загальна характеристика підгрупи карбону – ПІДГРУПА КАРБОНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 11. ПІДГРУПА КАРБОНУ § 11.1. Загальна характеристика підгрупи карбону До підгрупи карбону належать карбон, силіцій, германій, станум і плюмбум. Це р-елементи IV групи періодичної системи Д. І. Менделєєва, їх атоми на зовнішньому рівні містять по чотири електрони – ns2np2 (п. 2, […]...
- Загальна характеристика хімічних елементів ІА групи РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ ІА – ІІІА ГРУП § 57. Загальна характеристика хімічних елементів ІА групи Усвідомлення змісту цього параграфа дає змогу: Характеризувати і порівнювати хімічні елементи ІА групи за місцем у періодичній системі та електронною будовою атомів; їх поширеність у природі; Оцінювати їх біологічну роль. До ІА групи належать […]...
- Загальна характеристика підгрупи нітрогену – ПІДГРУПА НІТРОГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 10. ПІДГРУПА НІТРОГЕНУ § 10.1. Загальна характеристика підгрупи нітрогену Підгрупу нітрогену складають п’ять елементів: нітроген, фосфор, стибій, арсен і бісмут. Це р-елементи V групи періодичної системи Д. І. Менделєєва. На зовнішньому енергетичному рівні їх атоми мають по п’ять електронів – ns2 […]...
- Загальна характеристика хімічних елементів ІІА групи РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ ІА – ІІІА ГРУП § 61. Загальна характеристика хімічних елементів ІІА групи Усвідомлення змісту цього параграфа дає змогу: Характеризувати та порівнювати хімічні елементи ІІА групи за місцем у періодичній системі та електронною будовою атомів; поширеність у природі; Оцінювати їх біологічну роль. До ІІА групи періодичної системи […]...
- Загальна характеристика підгрупи оксигену – ПІДГРУПА ОКСИГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 9. ПІДГРУПА ОКСИГЕНУ § 9.1. Загальна характеристика підгрупи оксигену До підгрупи оксигену входять п’ять елементів: оксиген, сульфур, селен, телур і полоній (полоній – радіоактивний елемент). Це р-елементи VI групи періодичної системи Д. І. Менделєєва. Вони мають групову назву – халькогени, що […]...
- Загальні хімічні властивості металів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали 8.1.3. Загальні хімічні властивості металів Найтиповіша ознака металічних елементів – це здатність відносно легко віддавати електрони: 1. Взаємодія металів з простими речовинами (неметалами): А) з галогенами. Утворюються відповідні […]...
- Загальні способи добування металів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали 8.1.5. Загальні способи добування металів У вигляді самородних металів трапляється незначна кількість малоактивних металів: золото, платина, срібло. Більшість металічних елементів трапляється в природі у вигляді сполук – оксидів, […]...
- Загальна характеристика родини заліза – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.5. Загальна характеристика родини заліза У побічній підгрупі VIII групи періодичної системи елементів Д. І. Менделєєва розташовано 9 елементів: ферум, кобальт, нікол, рутеній, родій, паладій, осмій, іридій, платина. Подібні між собою елементи цієї групи утворюють горизонтальні […]...
- Фізичні властивості металів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали 8.1.2. Фізичні властивості металів Особливості металічного зв’язку і кристалічних граток зумовлюють загальні фізичні властивості різних металів. 1. Агрегатний стан металів твердий (крім ртуті й, умовно, францію1). Температура плавлення […]...
- Сульфітна кислота та її солі – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.9. Сульфітна кислота та її солі Сульфітна кислота Н2SO3 – це слабка двохосновна кислота, існує лише в розбавлених розчинах1. Дисоціює двоступенево: Хімічні властивості Виявляє властивості кислот; при взаємодії з лугами може утворювати […]...
- ПРОСТІ РЕЧОВИНИ. МЕТАЛИ Й НЕМЕТАЛИ, МЕТАЛІЧНІ Й НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ № 1. Прості речовини – це речовини, молекули яких складаються з елементів одного виду атомів. Залізо, алюміній, мідь, водень, кисень. № 2. Прості речовини поділяються на метали та неметали. До металів належать цинк Zn, калій К, кальцій Са, магній Mg, олово Sn, свинець Рb, мідь Сu, залізо Fe, алюміній Аl, срібло Ag, золото Аu. Прикладами […]...
- Загальні фізичні властивості металів – ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІВ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІВ Загальні фізичні властивості металів Металічні елементи займають в основному ліву нижню частину Періодичної системи хімічних елементів Д, І. Менделєєва. До металічних елементів належать ті елементи, в чиїх атомах на зовнішньому електронному рівні перебуває невелике (від одного до чотирьох) число електронів, […]...
- Загальна характеристика підгрупи галогенів – ВОДЕНЬ. ГАЛОГЕНИ-НЕОРГАНІЧНА ХІМІЯ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 8. ВОДЕНЬ. ГАЛОГЕНИ § 8.5. Загальна характеристика підгрупи галогенів Під час розгляду хімії елементів за підгрупами винятково важливо вміти використовувати прогнозуючу роль періодичного закону і періодичної системи елементів Д. І. Менделєєва. Тоді багато властивостей елементів і їх сполук можна описати, не […]...
- МЕТАЛІЧНІ ВЛАСТИВОСТІ – ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ МЕТАЛІЧНІ ВЛАСТИВОСТІ Застосування металів як таких базується саме на їх металічних властивостях. Мова йде про металічні властивості речовин, на відміну від металічних властивостей хімічних елементів. Спільним у будові всіх речовин металів є атомна кристалічна гратка і, внаслідок незаповненості електронами зони зв’язуючих молекулярних орбіталей, здатність електронів сприймати і передавати […]...
- ПРОСТІ РЕЧОВИНИ. МЕТАЛИ Й НЕМЕТАЛИ, МЕТАЛІЧНІ Й НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ Тема 1 ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ & 14. ПРОСТІ РЕЧОВИНИ. МЕТАЛИ Й НЕМЕТАЛИ, МЕТАЛІЧНІ Й НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ Вивчення параграфа допоможе вам: · наводити приклади простих речовин металів і неметалів; · розрізняти метали і неметали, металічні і неметалічні елементи; · користуватися періодичною системою як довідковою для визначення розміщення в ній деяких неметалічних і металічних хімічних елементів. ЯКІ […]...
- Контрольна робота з теми “Металічні елементи та їхні сполуки” ІІ семестр Тема 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (13 годин) УРОК 34 Контрольна робота з теми “Металічні елементи та їхні сполуки” Цілі уроку: узагальнити й систематизувати знання учнів з теми “Металічні елементи та їхні сполуки”; визначити рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на практиці. Тип уроку: контролю й […]...
- Місце елементів-неметалів у Періодичній системі – ГАЛОГЕНИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЯ ЕЛЕМЕНТІВ ГАЛОГЕНИ Місце елементів-неметалів у Періодичній системі Усі елементи в Періодичній системі Д. І. Менделєєва умовно можна розділити на два типи: металічні і неметалічні. До неметалічних відносять елементи, які схильні приймати електрони, а до металічних – елементи, які схильні їх віддавати. Як […]...
- ЗАГАЛЬНА ХАРАКТЕРИСТИКА НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ. НЕМЕТАЛИ ЯК ПРОСТІ РЕЧОВИНИ. ВЛАСТИВОСТІ НЕМЕТАЛІВ ТЕМА 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ УРОК 3. ЗАГАЛЬНА ХАРАКТЕРИСТИКА НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ. НЕМЕТАЛИ ЯК ПРОСТІ РЕЧОВИНИ. ВЛАСТИВОСТІ НЕМЕТАЛІВ Цілі: формувати знання про елементи-неметали, їх положення в періодичній системі, особливості простих речовин-неметалів, їх поширення в природі, застосування, властивості, значення озонового шару для життя організмів на Землі; формувати вміння пояснювати на прикладах поняття “алотропія”, “адсорбція”, складати […]...
- Елементи-метали в Періодичній системі – Метали Хімія Неорганічна хімія Метали Елементи-метали в Періодичній системі Якщо в Періодичній системі провести діагональ від Берилію до Астату, то зліва внизу розміщуватимуться елементи-метали (до них же належать елементи побічних підгруп). Атоми металів порівняно легко віддають електрони, перетворюючись на позитивно заряджені йони. Це пояснюється тим, що в атомів металів: – мале число електронів на зовнішньому енергетичному […]...