Загальна характеристика – Урок 3 – Елементи VIA групи
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
9. Неметалічні елементи та їхні сполуки. Неметали
9.3. Елементи VIA Групи
9.3.1. Загальна характеристика
До складу головної підгрупи VI групи1 належать Оксиген, Сульфур, Селен, Телур і Полоній. Елементи цієї підгрупи ще називають халькогенами2, або елементами підгрупи Оксигену.
Це p-елементи; будова зовнішнього електронного рівня халькогенів – ns2np4, де n – номер періоду.
Валентність елементів буває II, IV та VI, а в Оксигену
До завершення зовнішнього електронного шару халькогенам не вистачає двох електронів, а тому їхні атоми легко приєднують електрони, утворюючи йон Е2-, який є в йонних сполуках. У ковалентних сполуках, де халькоген є електронегативнішим елементом, він виявляє також найнижчий ступінь окиснення (-2). У сполуках з електронегативнішими неметалічними елементами всі халькогени (крім Оксигену) виявляють ступені окиснення +6 або +4.
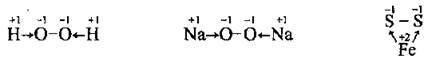
Оксиген виявляє позитивний ступінь окиснення +2 лише в сполуці з електронегативнішим Флуором OF2:
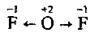
Сполуки елементів підгрупи Оксигену зі ступенем окиснення халькогену -2 виявляють відновні властивості, які посилюються закономірно зі зменшенням електронегативності в ряду від Сульфуру до Телуру.
У підгрупі зверху донизу зі збільшенням заряду ядра атома збільшуються атомні радіуси елементів і зменшується електронегативність, а тому закономірно змінюються властивості елементів: зменшуються їхні неметалічні властивості й окислювальна здатність і посилюються металічні властивості.
Халькогени утворюють леткі сполуки з Гідрогеном із загальною формулою Н2Е. Це задушливі гази (крім води), при розчиненні яких у воді утворюються відповідні слабкі кислоти. У ряду кислот H2S → H2Se → Н2Те відбувається зростання сили кислот.
Елементи групи утворюють кислотні оксиди складу ЕO2 та ЕО3, яким відповідають гідроксиди – кислоти Н2ЕO3 та Н2ЕO4. У ряду кислот H2SO4 → H2SeO4 → Н2ТеO4 сила кислот спадає.
________________________________________________________________
1 За новою номенклатурою – 16 групи.
2 Халькогени (від гр. χαλκος – руда і γενος – рід) – “ті, що народжують руди”.
3 Дж. Н. Льюїс 1919 p., вивчаючи магнітні властивості розчинів кисню в рідкому азоті, виявив молекули чотирьохатомного Оксигену O4.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Загальна характеристика – Урок 4 – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.1. Загальна характеристика До складу головної підгрупи V групи1 входять Нітроген N, Фосфор Р, Арсен As, Стибій Sb і Вісмут Ві. Будова зовнішнього електронного шару елементів – ns’2np3. Це p-елементи: Валентність Нітрогену […]...
- Загальна характеристика – Урок 5 – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.1. Загальна характеристика До складу головної підгрупи IV групи (14 групи) входять Карбон (С), Силіцій (Si), Германій (Ge), Станум (Sn) і Плюмбум (Рb). Будова зовнішнього електронного шару елементів – ns2nр2. Це p-елементи: […]...
- Загальна характеристика – Урок 2 – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.1. Загальна характеристика Лужноземельні металічні елементи – це s-елементи, які розміщуються у головній підгрупі II групи періодичної системи, а саме: Кальцій (Са), Стронцій (Sr), Барій (Ва), Радій (Ra). Інші […]...
- Загальна характеристика – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.1. Загальна характеристика Лужні металічні елементи – це s-елементи, які розміщуються у головній підгрупі І групи періодичної системи: Літій (Li), Натрій (Na), Калій (К), Рубідій (Rb), Цезій (Cs) та Францій […]...
- Загальна характеристика підгрупи оксигену – ПІДГРУПА ОКСИГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 9. ПІДГРУПА ОКСИГЕНУ § 9.1. Загальна характеристика підгрупи оксигену До підгрупи оксигену входять п’ять елементів: оксиген, сульфур, селен, телур і полоній (полоній – радіоактивний елемент). Це р-елементи VI групи періодичної системи Д. І. Менделєєва. Вони мають групову назву – халькогени, що […]...
- Загальна характеристика підгрупи бору – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.10. Загальна характеристика підгрупи бору Головну підгрупу III групи (підгрупу бору) складають елементи бор, алюміній, галій, індій і талій. Деякі властивості цих елементів наведено у табл. 13.3. Таблиця 13.3. Властивості елементів підгрупи бору Властивості В АІ […]...
- Оксиген – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.2. Оксиген Оксиген – 8-й елемент періодичної таблиці, заряд ядра – +8. Хімічний символ – О. Відомо три стабільні природні ізотопи Оксигену: 16O,17O, 18O, серед яких найчастіше трапляється 16О (99,76 %). Оксиген […]...
- Загальна характеристика підгрупи берилію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.5. Загальна характеристика підгрупи берилію Цю підгрупу складають берилій, магній і лужноземельні елементи (кальцій, стронцій, барій, радій). Деякі властивості цих елементів наведено в табл. 13.2. Таблиця 13.2. Властивості елементів підгрупи берилію Властивості Be Mg Са Sr […]...
- Загальна характеристика підгрупи карбону – ПІДГРУПА КАРБОНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 11. ПІДГРУПА КАРБОНУ § 11.1. Загальна характеристика підгрупи карбону До підгрупи карбону належать карбон, силіцій, германій, станум і плюмбум. Це р-елементи IV групи періодичної системи Д. І. Менделєєва, їх атоми на зовнішньому рівні містять по чотири електрони – ns2np2 (п. 2, […]...
- Загальна характеристика підгрупи хрому – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.1. Загальна характеристика підгрупи хрому До металів побічних підгруп періодичної системи Д. І. Менделєєва належать всі d-елементи. Таких підгруп 10: скандію, титану, ванадію, хрому, мангану, феруму, кобальту, ніколу, купруму та цинку. Тут розглядаються загальні характеристики підгрупи […]...
- Загальна характеристика підгрупи літію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.1. Загальна характеристика підгрупи літію Підгрупу літію складають елементи: літій, натрій, калій, рубідій, цезій та францій. Деякі властивості цих елементів наведено в табл. 13.1. Це s-елементи (див. табл. 13.1, п. 2). Атоми на зовнішньому енергетичному рівні […]...
- Загальна характеристика підгрупи нітрогену – ПІДГРУПА НІТРОГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 10. ПІДГРУПА НІТРОГЕНУ § 10.1. Загальна характеристика підгрупи нітрогену Підгрупу нітрогену складають п’ять елементів: нітроген, фосфор, стибій, арсен і бісмут. Це р-елементи V групи періодичної системи Д. І. Менделєєва. На зовнішньому енергетичному рівні їх атоми мають по п’ять електронів – ns2 […]...
- Загальна характеристика підгрупи галогенів – ВОДЕНЬ. ГАЛОГЕНИ-НЕОРГАНІЧНА ХІМІЯ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 8. ВОДЕНЬ. ГАЛОГЕНИ § 8.5. Загальна характеристика підгрупи галогенів Під час розгляду хімії елементів за підгрупами винятково важливо вміти використовувати прогнозуючу роль періодичного закону і періодичної системи елементів Д. І. Менделєєва. Тоді багато властивостей елементів і їх сполук можна описати, не […]...
- Загальна характеристика родини заліза – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.5. Загальна характеристика родини заліза У побічній підгрупі VIII групи періодичної системи елементів Д. І. Менделєєва розташовано 9 елементів: ферум, кобальт, нікол, рутеній, родій, паладій, осмій, іридій, платина. Подібні між собою елементи цієї групи утворюють горизонтальні […]...
- Загальна характеристика хімічних елементів ІА групи РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ ІА – ІІІА ГРУП § 57. Загальна характеристика хімічних елементів ІА групи Усвідомлення змісту цього параграфа дає змогу: Характеризувати і порівнювати хімічні елементи ІА групи за місцем у періодичній системі та електронною будовою атомів; їх поширеність у природі; Оцінювати їх біологічну роль. До ІА групи належать […]...
- Нітратна кислота – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.6. Нітратна кислота Нітратна кислота HNO3 – одна з найважливіших неорганічних кислот. Зв’язки між атомами в молекулі кислоти полярні ковалентні. Нітроген у нітратній кислоті виявляє свою максимальну валентність – IV, а ступінь […]...
- Сульфітна кислота та її солі – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.9. Сульфітна кислота та її солі Сульфітна кислота Н2SO3 – це слабка двохосновна кислота, існує лише в розбавлених розчинах1. Дисоціює двоступенево: Хімічні властивості Виявляє властивості кислот; при взаємодії з лугами може утворювати […]...
- Загальна характеристика хімічних елементів ІІА групи РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ ІА – ІІІА ГРУП § 61. Загальна характеристика хімічних елементів ІІА групи Усвідомлення змісту цього параграфа дає змогу: Характеризувати та порівнювати хімічні елементи ІІА групи за місцем у періодичній системі та електронною будовою атомів; поширеність у природі; Оцінювати їх біологічну роль. До ІІА групи періодичної системи […]...
- Приклади розв’язування типових задач – Урок 4 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок Приклади розв’язування типових задач Задача 1. Визначте ступені окиснення Фосфору в таких сполуках: К3Р, Na3PO4, К4Р2O7, Р2O5, Н3РO3. Розв’язання Задача 2. Визначте ступені окиснення Сульфуру в сполуках Na2SO3, Al2(SO4)3, Na2S2O3, SO2, SO3. Розв’язання Al2(SO4)3. Для встановлення ступеня окиснення Сульфуру можна […]...
- Магній – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.2. Магній Магній – 12-й елемент періодичної таблиці, заряд ядра – +12. Хімічний символ – Mg, відносна атомна маса – 24. Відомо три стабільні природні ізотопи Магнію: 24Mg (78,6 […]...
- Сульфур – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.5. Сульфур Сульфур – 16-й елемент періодичної таблиці, заряд ядра – +16. Хімічний символ – S, відносна атомна маса – 32. Відомо чотири стабільні природні ізотопи: 32S, 33S, 34S і 36S. Електронегативність […]...
- Кальцій – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.5. Кальцій Кальцій – 20-й елемент періодичної таблиці, заряд ядра – +20. Хімічний символ – Са. Відносна атомна маса – 40. Утворює просту речовину – сріблясто-білий метал кальцій. Виявляє […]...
- Солі ортофосфатної кислоти – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.12. Солі ортофосфатної кислоти Як трьохосновна кислота Н3РO4 утворює три ряди солей: 1) середні (нормальні): К3РО4 – калій ортофосфат, Mg3(PO4)2-магній ортофосфат; І кислі: 2) однозаміщені: КН2РO4 – калій дигідрогенфосфат, Са(Н2РO4)2 – кальцій […]...
- Характеристика хімічних елементів – ОКСИГЕН. СУЛЬФУР Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЯ ЕЛЕМЕНТІВ ОКСИГЕН. СУЛЬФУР Характеристика хімічних елементів Властивості хімічних елементів Властивість Оксиген Сульфур Хімічний символ 0 S Порядковий номер 8 16 Атомна маса 15,9994 32,06 Місце в ПС 2 період; VI група 3 період; VI група Число електронів на енергетичних рівнях 2; 6 […]...
- ЗАГАЛЬНА ХАРАКТЕРИСТИКА НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ. НЕМЕТАЛИ ЯК ПРОСТІ РЕЧОВИНИ. ВЛАСТИВОСТІ НЕМЕТАЛІВ ТЕМА 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ УРОК 3. ЗАГАЛЬНА ХАРАКТЕРИСТИКА НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ. НЕМЕТАЛИ ЯК ПРОСТІ РЕЧОВИНИ. ВЛАСТИВОСТІ НЕМЕТАЛІВ Цілі: формувати знання про елементи-неметали, їх положення в періодичній системі, особливості простих речовин-неметалів, їх поширення в природі, застосування, властивості, значення озонового шару для життя організмів на Землі; формувати вміння пояснювати на прикладах поняття “алотропія”, “адсорбція”, складати […]...
- Ортофосфатна кислота – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.11. Ортофосфатна кислота Ортофосфатна кислота Н3РO4 – це біла тверда речовина, температура плавлення – +42 °С, має необмежену розчинність у воді. Це речовина молекулярної будови, неотруйна. Графічна формула: Відомі також метафосфатна НРО3 […]...
- Загальна характеристика РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ IVA ГРУПИ До ІVА групи періодичної системи належать Карбон С, Силіцій Si, Германій Ge, Станум Sn і Плюмбум Pb. Карбон у вигляді сажі, кам’яного і деревного вугілля відомий з глибокої давнини. Назва Карбону походить від лат. carbo – вугілля. Й. Берцеліус (1779 – 1848) Д. І. […]...
- Силікатна кислота, силікати – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.8. Силікатна кислота, силікати Силікатна кислота Н2SiO3 – це найпростіша з полі-кремнієвих кислот, склад яких виражають формулою nSiO2 · mH2O. Як правило, силікатна кислота – це суміш різних полі-кремнієвих кислот, які різняться […]...
- Озон – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.4. Озон Озон O3 – це ще одна алотропна модифікація Оксигену. Відносна молекулярна маса – 48, молярна маса – 48 г/моль. Це газ зі своєрідним, різким “металічним” запахом, дуже отруйний. Озон – […]...
- Загальні хімічні властивості металів – ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІВ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІВ Загальні хімічні властивості металів В атомах металів на зовнішній електронній оболонці утримується невелике число електронів. Ці електрони порівняно легко можуть відриватися від атомів. Така особливість металів є причиною не тільки їхніх фізичних, але й хімічних властивостей. Виходячи з того, що […]...
- Оксиди Сульфуру – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.8. Оксиди Сульфуру Сульфур(ІV) оксид Сульфур утворює два оксиди – сульфур(ІV) оксид і сульфур(VІ) оксид. Найбільше значення серед сполук Сульфуру зі ступенем окиснення +4 має сульфур(ІV) оксид (сульфур діоксид, сірчистий газ) SO2. […]...
- Нітроген – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.2. Нітроген Нітроген – 7-й елемент періодичної таблиці, заряд ядра – +7. Хімічний символ – N. Відносна атомна маса – 14, молярна маса – 28 г/моль. Відомо два стабільні природні ізотопи Нітрогену: […]...
- Нітроген(IV) оксид – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.5. Нітроген( IV ) оксид Нітроген утворює п’ять оксидів зі ступенями окиснення +1, +2, +3, +4 і +5. Нітроген(ІV) оксид, нітроген діоксид NO2 за стандартних умов – це газ бурого кольору1 з […]...
- Калійні добрива – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.4. Калійні добрива Грунт – це верхній природний шар земної кори, основною характеристикою якого є родючість. Вона визначається багатьма факторами, зокрема вологістю та наявністю біогенних елементів2 – Нітрогену (30-50 мг/кг), […]...
- Сульфатна кислота – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.10. Сульфатна кислота Сульфатна кислота H2SO4 – це речовина молекулярної будови. Атом Сульфуру утворює шість ковалентних зв’язків і набуває ступеня окиснення +6: Безводна сульфатна кислота – це важка, оліїста рідина без кольору […]...
- Кальцій оксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.6. Кальцій оксид Кальцій оксид СаО має технічні назви палене вапно, негашене вапно. Кальцій оксид – сполука з яскраво вираженими основними властивостями. Добування кальцій оксиду У лабораторії: А) окисненням […]...
- Кальцій гідроксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.7. Кальцій гідроксид Кальцій гідроксид (Са(ОН)2). Насичений водний розчин кальцій гідроксиду називають вапняною водою, а білу суспензію кальцій гідроксиду – вапняним молоком. Одержання кальцій гідроксиду У лабораторії Са(ОН)2 одержують […]...
- Карбонатна кислота – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.4. Карбонатна кислота Карбонатна кислота Н2СO3 – слабка двохосновна кислота, існує в дуже розбавлених розчинах. Є слабким електролітом. Дисоціює двоступенево (II ступінь – у незначній мірі): Добування карбонатної кислоти Карбонатну кислоту одержують […]...
- Магній оксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.3. Магній оксид Магній оксид MgO – основний оксид. З водою не реагує, взаємодіє: – з кислотними оксидами (при нагріванні): – з кислотами: – із солями, витісняючи менш активні […]...
- Силіцій – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.6. Силіцій Силіцій – 14-й елемент періодичної таблиці, заряд ядра – +14. Хімічний символ – Si, відносна атомна маса – 28. Відомо три стабільні природні ізотопи Силіцію: 28Si (92,27 %), 29Si, 30Si. […]...