Загальна характеристика хімічних елементів ІА групи
РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ ІА – ІІІА ГРУП
§ 57. Загальна характеристика хімічних елементів ІА групи
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати і порівнювати хімічні елементи ІА групи за місцем у періодичній системі та електронною будовою атомів; їх поширеність у природі;
Оцінювати їх біологічну роль.
До ІА групи належать металічні елементи Літій Li, Натрій Na, Калій K, Рубідій Rb, Цезій Cs і Францій Fr. Ці елементи називають лужними, оскільки їх основи є лугами. Утворені ними
Назва Літію походить від грец. lithjis – камінь, Калію – від назви поташу – “алькалі” (араб.); раніше його називали “потасій”. Натрій походить від neter – “речовина, що бурлить”; спочатку його називали “содій”. Звідси й назви карбонатних солей Калію і Натрію: поташ і сода. Назви Цезій (з лат. – блакитний) і Рубідій (з лат. – темно – червоний) пов’язані з синіми і червоними лініями спектра, за якими вони були відкриті. Радіоактивний елемент Францій був передбачений Д. І. Менделєєвим,
Літій, натрій і калій уперше були одержані англійським ученим Г. Деві (1807 р.).
Загальну характеристику елементів ІА групи розглянемо за даними, наведеними в табл. 19.
Т а б л и ц я 19
Загальна характеристика хімічних елементів ІА групи
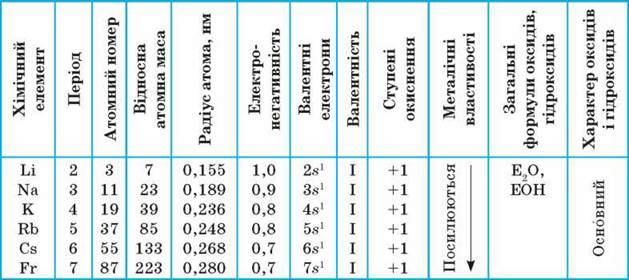
Електронна будова і властивості атомів. На s-підрівні зовнішнього енергетичного рівня атоми лужних елементів мають по одному валентному електрону, що відповідає електронній конфігурації ns1. Цей електрон розміщений на значній відстані від ядра порівняно з іншими елементами того самого періоду. Ось чому лужні елементи мають найменші значення електронегативності, їх атоми легко віддають цей електрон, перетворюючись на однозарядні йони:
Відрізняються лужні елементи атомним радіусом: найменший у Літію, найбільший – у Францію. Зі зростанням атомного номера елементів і збільшенням атомного радіуса їх металічні властивості закономірно посилюються.
У всіх сполуках (оксидах, основах, солях) лужні елементів утворюють переважно йонні зв’язки. Виявляють сталий ступінь окиснення +1 і валентність І. Це s-елементи і типові представники металічних елементів.
Їх прості речовини є типовими металами. Характер властивостей оксидів Е2О і гідроксидів ЕОН основний. З Гідрогеном утворюють гідриди ЕН так само йонної будови із ступенем окиснення лужного елемента +1 і Гідрогену -1.
Поширеність у природі. Внаслідок хімічної активності лужні елементи у природі існують лише у вигляді сполук. Натрій і Калій належать до найпоширеніших елементів, Літію значно менше, Рубідій і Цезій – рідкісні елементи.
На мал. 23 і 100 зображено найпоширеніші природні сполуки лужних елементів: Li – лепідоліт LiCl, сподумен Li2O – Al2O3 – 4SiO2; Na – галіт (кам’яна сіль) NaCl, бура Na2B4O7, мірабіліт (глауберова сіль) Na2SO4 – 10H2O, чилійська селітра NaNO3, кріоліт Na3[AlF6]; K – сильвініт KCl – NaCl, карналіт KCl – MgSO4 – 6H2O, сильвін KCl.
В Україні найбільші родовища кам’яної солі – в Артемівську (Донбас), Калуші (Прикарпаття), в озері Саки (Крим).
Біологічна роль. Організм людини масою 70 кг містить 56 – 70 г Натрію і 160 – 250 г Калію. Їх біологічна роль є дуже важливою: Натрій – головний позаклітинний елемент, Калій – основний внутрішньоклітинний елемент. Вони виконують різні функції в організмі, однак від їх злагодженої “роботи” залежить здоров’я людини. Співвідношення концентрації їх йонів регулює кров’яний тиск людини. У складі гідро-генкарбонатів і гідрогенфосфатів вони підтримують кислотно-лужний баланс плазми крові. Натрій входить до складу еритроцитів і впливає на газообмін в організмі. Калій є активатором ферментів, без яких неможливий вуглеводний обмін і синтез білків, нормалізує роботу серцевого м’яза.
Крім зазначеного, йони Натрію і Калію виконують протилежні, але важливі функції: йони Na+ затримують воду в організмі, а йони К+ впливають на сечогінну систему. Багата на Калій їжа посилює виділення із сечею Натрію з організму. І навпаки, при споживанні великої кількості кухонної солі з організму виводиться Калій.

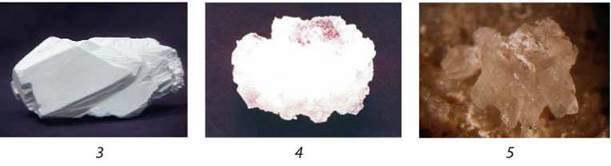
Мал. 100. Природні сполуки лужних елементів. Li: 1 – лепідоліт, 2 – сподумен;
Na: 3 – бура, 4 – мірабіліт (глауберова сіль), 5 – чилійська селітра
Саме тому таким важливим є баланс цих елементів у споживанні харчових продуктів. Добова потреба людини в Натрію становить 0,8 – 1,0 г. Надлишок кухонної солі в їжі спричиняє порушення функцій нирок, статевої системи, а також підвищення кров’яного тиску (гіпертонію). Добова потреба дорослої людини в Калію – 2,5 – 3,5 г. Сполуки Калію усувають набряки, запобігають захворюванню на ревматизм, поліпшують роботу серця. Продукти, багаті на Калій, зображено на мал. 101.
Калій – один з найважливіших елементів для розвитку рослин. Він міститься в протоплазмі клітин і забезпечує нормальне засвоєння вуглекислого газу й азоту, регулює процеси дихання, переміщення розчинів солей від коренів до листків, підвищує стійкість рослин до хвороб і несприятливих умов, поліпшує поживні якості плодів.

Мал. 101. Харчові продукти з найбільшим вмістом Калію
Літій, Рубідій і Цезій також входять до організму людини, але біологічна роль їх ще не з’ясована.
Коротко про головне
До ІА групи періодичної системи належать шість металічних елементів: Літій Li, Натрій Na, Калій K, Рубідій Rb, Цезій Cs і радіоактивний Францій Fr. Їх називають лужними елементами, а їх прості речовини – лужними металами.
Атоми мають на зовнішньому енергетичному рівні лише один валентний електрон, відрізняються атомним радіусом, що закономірно збільшується зі зростанням атомного номера елементів. Саме тому всі ці елементи є типовими металічними елементами, в групі із зростанням атомного номера їх металічні властивості посилюються. В сполуках перебувають у вигляді однозарядних йонів. Утворюють основні оксиди Е2О, основи ЕОН, які є лугами, і гідриди ЕН.
У природі найпоширеніші сполуки Натрію і Калію. Роль йонів Натрію і Калію в організмі людини є надзвичайно важливою.
