Загальна характеристика хімічних елементів ІІА групи
РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ ІА – ІІІА ГРУП
§ 61. Загальна характеристика хімічних елементів ІІА групи
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати та порівнювати хімічні елементи ІІА групи за місцем у періодичній системі та електронною будовою атомів; поширеність у природі;
Оцінювати їх біологічну роль.
До ІІА групи періодичної системи належать Берилій Ве, Магній Mg, Кальцій Са, Стронцій Sr, Барій Ва і радіоактивний елемент Радій Ra. Серед них лише Кальцій, Стронцій, Барій
Назви частини елементів походять від назв їх природних сполук. Наприклад, Берилій – від назви напівкоштовного каменю берилу (різновид ізумруду), Магній – від назви мінералу магнезії, знайденого біля грецького міста Магнезія, Стронцій і Барій – від назв мінералів відповідно стронціаніту та бариту. Назва Кальцію пов’язана з латинським словом calcis – вапно, м’який камінь. Радій у перекладі з латинської означає “промінь”.
Електронна будова і
Т а б л и ц я 20
Загальна характеристика хімічних елементів ІІА групи
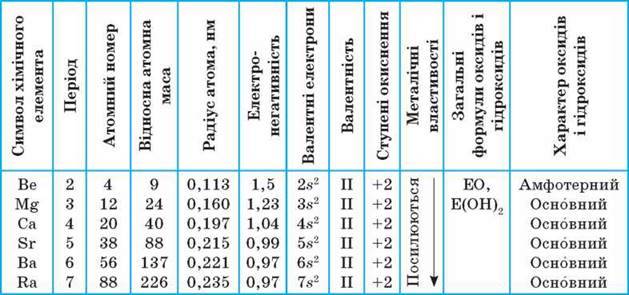
Порівняно з лужними елементами кожного періоду в них більше електронів, більший заряд ядра і, як наслідок, менший радіус атома, що посилює притягання валентних електронів до ядра. Тому всі елементи ІІА групи за металічними властивостями поступаються лужним елементам.
Відрізняються атоми елементів ІІА групи між собою атомним радіусом, який у ряді Ве – Ra закономірно збільшується, зумовлюючи відповідне зменшення електронегативності та посилення металічних властивостей.
Віддаючи два електрони, атоми лужноземельних елементів Са, Sr і Ва перетворюються на двозарядні йони:
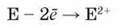
У їх сполуках (оксидах, гідроксидах, солях) переважає здебільшого йонний зв’язок. На відміну від них Берилій утворює в основному сполуки з ковалентним зв’язком, а Магній – з йонним та ковалентним зв’язками. Ступінь окиснення хімічних елементів цієї групи у сполуках дорівнює +2, валентність ІІ.
Хімічна активність і металічні властивості простих речовин елементів ІІА групи зростають від Берилію до Барію. Так само зростають електролітична сила і розчинність у воді їх основ. Тож прості речовини лужноземельних елементів є типовими металами, характер властивостей їх оксидів і гідроксидів – основний, гідроксиди розчиняються у воді і є лугами. З Гідрогеном утворюють гідриди МеН2, так само йонної будови.
Магній теж типовий метал, але його оксид МgO і гідроксид Мg(OН)2 малорозчинні у воді, гідроксид є основою, але до лугів не належить.
Берилій за своїми властивостями подібний до Алюмінію: його оксид і гідроксид не розчиняються у воді, за властивостями є амфотерними.
Поширеність у природі. Хімічні елементи ІІА групи через свою активність, як і лужні елементи, у природі існують у складі сполук. Найбільш розповсюдженими є Кальцій і Магній. Берилій, Стронцій і Барій належать до рідкісних хімічних елементів. На мал. 108 зображено природні сполуки елементів ІІА групи: Берилію – ізумруд Al2O3 – 6SiO2 (з домішками Cr2O3); Магнію – магнезит MgCO3; Кальцію – ангідрит СаSO4; Стронцію – стронціаніт SrCO3; Барію – барит BaSO4.
Біологічна роль хімічних елементів ІІА групи різноманітна і багатофункціональна. Так, Магній є складовою хлорофілу рослин, без якого неможливий фотосинтез. Він впливає на засвоєння рослинами Фосфору, підвищення вмісту цукру в цукрових буряках, крохмалю в картоплі. Організм людини масою 70 кг містить близько 60 г Магнію, при цьому 50 % його концентрується в скелеті. Разом із Фосфором і Калієм Магній впливає на засвоєння Кальцію. Нестача в організмі людини Магнію призводить до порушень у роботі серця, підвищує схильність до інфаркту. До організму людини надходить разом з питною водою та харчовими продуктами, серед яких найбільш багаті на Магній – картопля, помідори, капуста, персики, абрикоси.
Кальцій у живій природі з-поміж металічних елементів є головним біоелементом. Організм людини масою 70 кг містить 1,7 кг Кальцію.

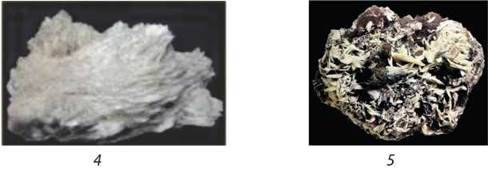
Мал. 108. Природні сполуки елементів ІІА групи.
Ве: 1 – ізумруд; Mg: 2 – магнезит; Ca: 3 – ангідрит; Sr: 4 – стронціаніт; Ва: 5 – барит
Це будівельний матеріал кісткової тканини, за його участю відбувається перетворення хімічної енергії в м’язах, він забезпечує здатність крові зсідатися. Нестача Кальцію призводить до розм’якшення кісток і розвитку рахіту. Потреба організму людини в Кальцію задовольняється в основному за рахунок молочних продуктів.
Стронцій як аналог Кальцію здатний брати активну участь в обміні речовин і відкладатися в кістковій тканині, заміщуючи Кальцій. Це може мати небезпечні наслідки. Річ у тому, що внаслідок ядерних реакцій, наприклад під час випробування ядерної зброї, утворюються понад 200 радіоактивних ізотопів різних хімічних елементів. Більшість з них є короткоживучими. А ізотоп Стронцій-90 має період напіврозпаду 27,7 року. За цей час може відбутися накопичення значної його кількості в кісткових тканинах людини, через що організм зазнає довготривалого радіоактивного опромінювання і можливий розвиток ракових пухлин, руйнування кровотворних органів. Стабільні ізотопи Стронцію постійно містяться в живих організмах, не завдаючи їм шкоди.
Берилій безпечний для рослин, але отруйний для тварин. Його накопичення призводить до розм’якшення кісткової тканини (берилієвий рахіт).
Розчинні у воді сполуки Барію є сильними отрутами, які, потрапляючи в організм людини, уражають міокард серця, нервову систему, кровоносні судини, кісткову тканину.
Коротко про головне
До елементів ІІА групи періодичної системи належать Берилій Ве, Магній Mg, Кальцій Са, Стронцій Sr, Барій Ва і радіоактивний елемент Радій Ra. Серед них Кальцій, Стронцій, Барій і Радій та їх прості речовини називаються лужноземельними. Електронна будова атомів усіх елементів ІІА групи однакова: на зовнішньому енергетичному рівні містяться два валентні електрони, що відповідає електронній конфігурації ns2. Усі елементи є металічними. Характер властивостей оксидів і гідроксидів Магнію та лужноземельних елементів – основний, але гідроксиди лужноземельних елементів розчиняються у воді і є лугами, магній гідроксид нерозчинний у воді й до лугів не належить. Берилій утворює амфотерні оксид і гідроксид.
Магній і Кальцій є одними з найважливіших і найпоширеніших елементів. Вони трапляються у природі лише в сполуках, мають велике значення для живих організмів. Берилій і Барій не мають великого розповсюдження в живій природі.
