Залізо
РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ ІА – ІІІА ГРУП
§ 68. Залізо
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати фізичні та хімічні властивості заліза, поширеність у природі, застосування;
Складати рівняння та схеми електронного балансу відповідних хімічних реакцій.
Фізичні властивості. Залізо – метал з металічною кристалічною граткою, що й зумовлює його фізичні властивості. Залізо високої чистоти – це блискучий сріблясто-сірий, пластичний метал, що добре піддається механічній
Хімічні властивості заліза визначаються електронною будовою атома і місцем у витискувальному ряді металів, а також станом його подрібнення. Залізо належить до металів середньої хімічної активності.
Взаємодія з кислотами. У
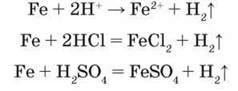
Розбавлена нітратна кислота повільно реагує із залізом за стандартних умов. Залежно від концентрації нітратної кислоти утворюються різні продукти відновлення. У розбавленій нітратній кислоті утворюються йони Феруму Fe3+, а в дуже розбавленій – йони Феруму Fe2+:
Fe + 4HNO3 (розб.) = Fe(NO3)3 + NO + 2H2O
8Fe + 3OHNO3 (розб) = 8Fe(NO3)3 + 3N2O + 15Н2О
4Fe + 10HNO(дуже розб.) = 4Fe(NO3)2 + NH4NO3 + 3H2O
– Доведіть відновні властивості заліза, склавши схеми електронного балансу.
Залізо реагує з концентрованими сульфатною і нітратною кислотами лише при нагріванні, утворюючи солі Феруму(ІІІ):
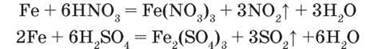
– Доведіть відновні властивості заліза, склавши схеми електронного балансу.
За стандартних умов залізо практично не взаємодіє з концентрованими нітратною і сульфатною кислотами, бо вони пасивують його. Ці кислоти перевозять у залізних цистернах.
Взаємодія з водою відбувається за певних умов. За стандартних умов – лише за наявності кисню:
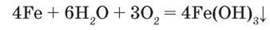
У вологому повітрі залізо покривається крихким шаром іржі. Зазначимо, що метеоритне майже не зазнає корозії. Іржа не має постійного хімічного складу, її хімічну формулу можна записати як Fe2O3 – nН2О. Розжарене залізо реагує із водяною парою з виділенням водню:
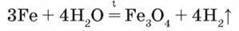
Fe3O4 – подвійний оксид, його формулу можна записати як FeO – Fe2O3. Хімічна назва – ферум(ІІ, III) оксид, а тривіальна – залізна ожарина. Раніше таким промисловим способом добували водень.
– Визначте властивості заліза, склавши схеми електронного балансу. Реакція з розчинами солей. Залізо витісняє з розчинів солей менш активні метали, наприклад олово, свинець, мідь, утворюючи солі Феруму(ІІ):
Fe + Cu2+ = Cu + Fe2+
На відміну від інших металів залізо може вступати в реакцію із солями Феруму(ІІІ):
Fe + Fe2(SO4)3 = 3FeSO4
– Визначте властивості Феруму та йона Fe3.
Взаємодія заліза з неметалами. У цих реакціях залізо завжди є відновником. При нагріванні, особливо в подрібненому стані, воно окиснюється майже усіма неметалами. Усі реакції – екзотермічні.

Мал. 125. Спалювання заліза в кисні
– Чому в подрібненому стані хімічна активність заліза посилюється?
При зберіганні на повітрі за температури до 200 °C залізо реагує з киснем, поступово покривається щільною плівкою оксиду, що перешкоджає подальшому окисненню металу. Під час згоряння заліза на повітрі утворюється ферум(ІІІ) оксид Fe2O3, а в чистому кисні – подвійний оксид – ферум(ІІ, ІІІ) оксид Fe3O4. Якщо кисень або повітря пропускати крізь розплавлене залізо, то утворюється ферум(ІІ) оксид FeO.
Дослід. Спалювання заліза в кисні.
На дно скляної банки насипають шар піску і наповнюють киснем. На кінці тонкої стальної дротинки, струни або голки закріпляють головку сірника. Виріб укріплюють на металевому стрижні або беруть тигельними щипцями і запалюють сірникову головку. Як тільки вона
Розгориться і нагріє залізо, його вносять у банку з киснем. Залізо згоряє, розбризкуючи іскри (мал. 125); продуктом реакції є ферум (ІІ, ІІІ) оксид.
У дуже подрібненому стані залізо самозаймається на повітрі. Залізо активно згоряє в хлорі, утворюючи кристали червоно-коричневого кольору ферум(ІІІ) хлориду (див. мал. 30, в). Зверніть увагу, що продуктом взаємодії заліза з хлором є ферум(ІІІ) хлорид.
Залізо при нагріванні в подрібненому стані також реагує з сіркою, утворюючи ферум(ІІ) сульфід. Отже, у реакціях з кислотами, водою і солями Ферум виявляє відновні властивості.
– Складіть рівняння хімічних реакцій взаємодії заліза з киснем, хлором і сіркою. За яких умов відбуваються ці реакції? Які ступені окиснення Феруму в продуктах реакцій?
У промисловості використовують його сплави, найчастіше чавун і сталь. Про їх виробництво ви дізнаєтеся з наступних параграфів.
Коротко про головне
Залізо високої чистоти – це блискучий сріблясто-білий, пластичний метал, що добре піддається механічній обробці, електро – та теплопровідний, має магнітні властивості. Температури плавлення та кипіння досить високі. Це метал середньої хімічної активності. В усіх реакціях – відновник. Як метал, що у витискувальному ряді міститься до водню, витісняє його з кислот (крім нітратної) і води, менш активні метали – з розчинів солей. При нагріванні та в подрібненому стані активно взаємодіє з неметалами. Застосовується здебільшого у вигляді сплавів – чавуну і сталі.
