БІЛОК І РІВНІ ЙОГО ОРГАНІЗАЦІЇ
Розділ 2 Молекулярний рівень організації живої природи
Тема 5. Біомолекулярний склад живого
§ 22. БІЛОК І РІВНІ ЙОГО ОРГАНІЗАЦІЇ
Терміни та поняття: протеїни, білки, пептидний, йонний, дисульфідний, водні та гідрофобні зв’язки, первинна молекулярна філогенія, вторинна, третинна, четвертина структури, а-спіраль, в-структура, денатурація.
Яка хімічна будова білків. Білки було виділено в окремий клас біологічних молекул ще у XVIII ст., коли було відзначено їх унікальну властивість перетворюватися на желеподібну речовину при нагріванні
Поліпептиди, які мають величезні розміри і молекулярну масу понад 6000, називають білками. До складу білків, крім Карбону, Гідрогену, Оксигену, Нітрогену і Сульфуру – елементів, що утворюють амінокислоти, можуть входити ще Фосфор, Ферум, Цинк і Купрум, які утворюють з білками молекулярні комплекси (табл. 6).
Поліпептидні ланцюги білків, на відміну від полісахаридів, не мають розгалуженої структури.
Таблиця 6.
Елементний склад білків, %
Карбон | 50-55 |
Оксиген | 21-24 |
Нітроген | 15-18 |
Гідроген | 6,5-7,5 |
Сульфур | 0,3-2,5 |
Фосфор | 1-2 |
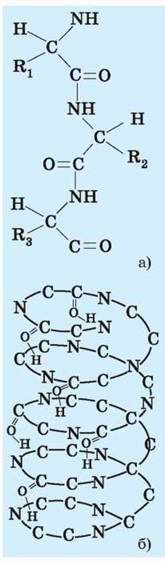
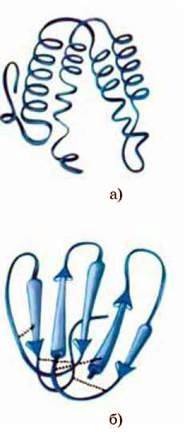
Мал. 116.Рівні організації молекули білка: а – первинна; б – вторинна
Тому не випадково, що в клітині білків більше, ніж будь-яких інших органічних сполук. У сухій речовині клітини на білки припадає більше ніж 50 %. Білки – це найважливіший компонент їжі тварин.
Якими зв’язками утримуються амінокислоти в молекулах білків. Амінокислоти настільки різноманітні за будовою, що між їх атомами виникають “нетрадиційні” для органічних сполук взаємодії, завдяки яким утворюються кілька різних типів зв’язків.
Пептидний зв’язок – зв’язок, за допомогою якого сполучаються амінокислоти й утворюється поліпептид – ний ланцюг.
Йонний зв’язок виникає між кінцевими, а також вільними групами кислих (-СООН) та лужних (-NH2) амінокислот, які перебувають у розчині в іонізованому стані. При зміні рН йонні зв’язки руйнуються. (Як ви вважаєте, чому?)
Дисульфідний зв’язок утворюється між сульфідними групами (-SH) залишків амінокислоти цистеїну. Як і пептидний, він належить до ковалентного. Дисульфідні зв’язки виникають як між окремими частинами однієї молекули, так і між різними молекулами білків (мал. 115).
Водневі зв’язки виникають між електропозитивними атомами Гідрогену в гідроксильній аміноргупі (-OH, – NH2) і електронегативними атомами Оксигену карбоксильної – С=О-групи. Ці зв’язки значно слабкіші за ковалентні, однак оскільки їх буває дуже багато, то їх внесок у стабільність молекули може бути значним.
Гідрофобні зв’язки утворюються між неполярними амінокислотами в розчинах. Це свого роду протиставлення водневим зв’язкам. Гідрофобні зв’язки слабкіші навіть за водневі, але через їхню численність їх цілком достатньо для підтримування форми молекули.
Рівні організації білків. Різноманітність будови поліпептидних ланцюгів на рівні окремих амінокислот приводить до того, що кожний білок має свою тривимірну форму, яка, як ви напевно пам’ятаєте, називається конформацією. Однак при цьому всі білки без винятку мають три, а деякі і чотири рівні просторової структурної організації молекули (мал. 116, 117).
Первинна структура – це сполучені пептидними зв’язками залишки амінокислот, що мають вигляд лінійної молекули. Амінокислоти в поліпептидному ланцюгу розміщуються не випадково, а в певному фіксованому порядку, і саме цей порядок визначає хімічні й фізичні властивості та функції білка.
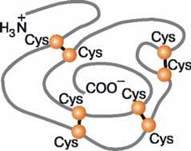
Мал. 115.Схема утворення дисульфідних зв’язків у молекулі білка (Cys – молекули цистеїну)
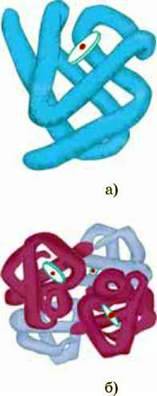
Мал. 117.Рівні організації молекули білка: а – третинна; б – четвертинна
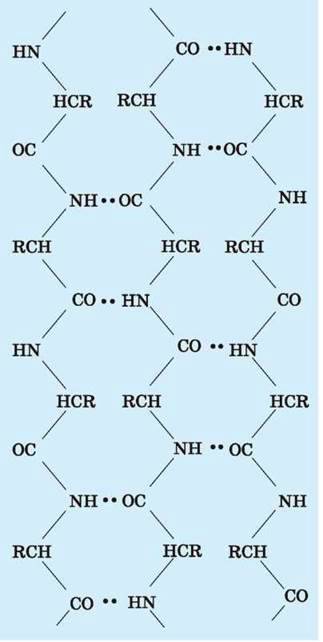
Мал. 118.Схема утворення β-структури білків
Підраховано, що у невеликому поліпептидному ланцюзі, який складається лише із 150 амінокислот, можуть утворитися понад мільярд комбінацій амінокислот. Звідси випливає, що кожний вид білка має свою унікальну амінокислотну послідовність. Оскільки до складу білка входять як кислі, так і лужні амінокислоти, будь-який білок має амфотерні властивості. При нейтральному значені рН залежно від балансу кислих чи лужних амінокислот більшість водорозчинних білків мають певний заряд і здатні рухатися в електричному полі або до аноду, або до катоду. Ця властивість використовується для розділення суміші білків, що досягається електрофорезом у спеціальних носіях – гелях. Значення рН, при якому в білку кількість негативно за ряд же них груп відповідає кількості позитивно заряджених, є ізоелектричною точкою білка. При цьому він втрачає здатність рухатися в електричному полі.
Раніше встановлення амінокислотної послідовності будь-якого білка забирало багато років. Першим білком, в якого була розшифрована послідовність залишків амінокислот, був інсулін. (Пригадайте, яку функцію виконує цей гормон.) Ці дослідження були проведені в Кембриджському університеті впродовж 10 років (1945-1954), а їх автор – лауреат Нобелівської премії Ф. Сенгер (нар. 1918). Безпосереднє визначення амінокислотної послідовності і на сьогодні залишається досить складною справою, навіть за наявності спеціальних приладів, які автоматизують цей процес. У наш час визначені послідовності сотень білків найрізноманітніших організмів.
Як виявилося, чим більш спорідненими є між собою види тварин і рослин, тим подібніший у них порядок амінокислотних послідовностей гомологічних білків. Це дає можливість кількісно оцінити спорідненість видів, що належать до різних груп організмів. Цей напрям у систематиці тварин і рослин, який дістав назву молекулярної філогенії, сформувався в останні десятиліття XX ст., але завдяки йому вже отримано ряд важливих наукових результатів. Зокрема з’ясувалося, що в людини і шимпанзе більш ніж 98 % білків мають ідентичні амінокислотні послідовності, а тому вчені говорять, що людину і шимпанзе “виліплено з одного молекулярного тіста”.
Мал. 119.Приклади білків, що побудовані з: а – а-спіралі; б – тільки P-структур
Для порівняння: у зовні дуже схожих видів гризунів або мушок-дрозофіл лише близько 75 % білків мають ідентичні амінокислотні послідовності.
Вторинна структура білка частіше за все являє собою закручений у спіраль поліпептидний ланцюг. Цей факт встановили американські вчені Л. Полінг (1901-1994) і Р. Корі (1897-1971) в 1951 р., використавши рентгено – структурний аналіз. Такий тип конформації був названий а-спіраллю, яку зазвичай порівнюють із гвинтовою драбиною. Висота кожної “сходинки” відповідає розмірам залишку однієї амінокислоти, а висота одного оберту – 3,6 амінокислотних залишків. Вважається, що така просторова форма молекули білка енергетично най – вигідніша. Спіраль утворюється внаслідок водневих зв’язків, які виникають між залишками СО-групи однієї амінокислоти та NH-групи іншої амінокислоти, віддаленої саме на чотири амінокислотних залишки. Водневі зв’язки значно слабкіші за ковалентні, але завдяки тому, що спіраль “прошита” численними водневими зв’язками, її структура дуже міцна.
Крім того, в деяких білках має місце укладка у вигляді так званих P-структур (мал. 118). У цьому випадку поліпептидні ланцюги розтягнуті і мають вигляд шарів, стабілізованих водневими зв’язками (мал. 119).
Третинна структура білка виникає автоматично з вторинної і є наслідком взаємодії амінокислотних радикалів з молекулами розчинника. При цьому гідрофобні ділянки молекули втягуються усередину молекули, а гідрофільні залишаються ззовні. Таким чином форму й об’єм молекули білка в тривимірному просторі формують гідрофобні зв’язки, які є дуже слабкими. Однак ця їх особливість в даному випадку не вада, а навпаки, їхня перевага, бо робить структуру білка лабільною. У деяких білків третинна структура молекули може стабілізуватися ще й ковалентними зв’язками за рахунок утворення дисульфідних містків між молекулами цистеїну, розташованими на віддалених частинах молекули.
Не існує навіть двох різних білків, які б мали цілком однакову третинну структуру. Це означає, що кожному виду білка властива унікальна, причому досить химерна, форма укладки молекули, яка є найкращою для її ефективного функціонування.
Стабільність третинної структури залежить від внутрішньоклітинного середовища, зокрема від рН і температури. Значні коливання температури або зміни хімічного складу клітини порушують третинну структуру білка і негайно впливають на його функціонування. Надмірне нагрівання або вплив сильнодіючих хімічних речовин призводить до денатурації (від лат. де – відокремлення і натура – природні властивості) – руйнування третинної структури білка. Саме тому такою небезпечною для людини є температура, вища за +41 °С. При такій температурі вже може початися денатурація білків, що неминуче призведе до смерті.
Четвертинна структура. Окремі види білків утворюють надмолекулярні структури, у яких звичайно сполучені дві або чотири однакові чи дуже близькі за будовою молекули. Об’єднання цих молекул в одну структуру відбувається за рахунок іонних і водневих зв’язків. Наприклад, гемоглобін – пігмент крові людини – складається
З чотирьох сполучених одна з одною молекул-субодиниць, дві з яких називаються а-гемоглобінами, а дві – P-гемоглобінами (мал. 120). Ці субодиниці, сполучившись, утворюють надмолекулярний комплекс, який має вигляд правильного тетраедра. Вважається, що четвертин на структура характерна для білків, функції яких особливо важливі для організму, а тому їх активні центри мають бути дуже стабільними.
Молекули білка – це біополімери, що, на відміну від вуглеводів, являють собою лінійний нерозгалужений ланцюг, ланки якого відрізняються хімічними й фізичними властивостями та можуть сполучатися зв’язками різного типу. Ще одна відмінність білків від полісахаридів полягає в тому, що білки мають кілька структурних рівнів організації.