Електроліз
РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
§ 55. Електроліз
Усвідомлення змісту цього параграфа дає змогу:
Формулювати означення електролізу;
Пояснювати суть електролізу розплавів і розчинів солей;
Прогнозувати склад продуктів електролізу: розплавів солей, розчинів солей за активністю йонів у розчині;
Складати рівняння реакцій електролізу, схеми окисно-відновних процесів на електродах;
Характеризувати практичне значення електролізу.
Значна кількість металів у промисловості добувається з руд способом, який
У лабораторних умовах електроліз здійснюють у спеціальному приладі – електролізері (мал. 94).
Англійський хімік і фізик, один із засновників електрохімії Г. Деві відкрив натрій, калій, кальцій, магній електролізом розплавів їх солей. Добув водень і кисень електролізом води. Запропонував гідрогенну теорію кислот, відкрив знеболюючу дію нітроген(І) оксиду, винайшов безпечну рудникову лампу. Висловив думку про важливість мінеральних солей для живлення рослин.

Г. Деві (1778 – 1829)
Мал. 94. Електролізер
Дослід. В U-подібну трубку наливаємо розчин купрум(ІІ) хлориду з масовою часткою солі 5 %, який містить катіони Cu2+ та аніони Cl-. В обидві частини трубки занурюємо вугільні електроди, які підключаємо до джерела постійного струму. Під дією електричного струму катіони купруму Cu2+ рухаються до негативного електрода – катода (K-) й осідають на ньому у вигляді металічної міді. Аніони хлору Cl – рухаються до позитивного електрода – анода (A+), утворюючи газ хлор Cl2.
Розглянемо процеси, які відбуваються на електродах. На катоді (K-) катіони купруму Cu2+ приєднують два електрони з катода і відновлюються до міді:
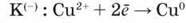
– відновлення
На аноді (A+) аніони хлору Cl віддають електрони аноду й окиснюються до хлору:
A(+) : Cl – – 1е -› Cl0 – окиснення 2Cl = Cl2 Таким чином, під дією електричного струму купрум(ІІ) хлорид у розчині розкладається на прості речовини – мідь і хлор.
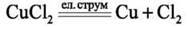
Характерною особливістю цього окисно-відновного процесу є те, що окиснення і відновлення відбуваються за участю електродів: катод (K-), на якому надлишок електронів, є відновником; анод (A+), на якому нестача електронів, – окисником.
Електроліз – окисно-відновні процеси, що відбуваються на електродах під час пропускання постійного електричного струму крізь розчин або розплав електроліту.
Для запам’ятовування суті катодних і анодних процесів існує мнемонічне правило (правило запам’ятовування):
– на катоді катіони відновлюються (усі слова починаються з приголосної).
– на аноді аніони окиснюються (усі слова починаються з голосної).
З’ясуємо, чи відрізняються окисно-відновні процеси, які відбуваються при електролізі розплавів і розчинів.
Електроліз розплавів. У розплавах електроліти – солі та луги – дисоціюють на відповідні йони, які окиснюються і відновлюються на електродах.
Електроліз розплаву натрій хлориду. В розплаві натрій хлорид дисоціює з утворенням катіонів натрію Na+ та аніонів хлору Cl-.
NaCl = Na+ + Cl-
На катоді відбувається відновлення катіонів натрію з утворенням металічного натрію, а на аноді – окиснення аніонів хлору з утворенням хлору:
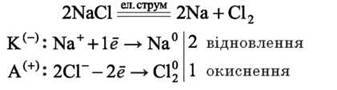
Електроліз розчинів. При електролізі водних розчинів електролітів, крім йонів-електролітів, у реакції можуть брати участь катіони Гідрогену H+ та гідроксид-іони OH – молекули води. Вода – слабкий електроліт, тому концентрація йонів H+ та OH – у розчині надзвичайно низька. У процесі електролізу полярні молекули води наближаються до електродів протилежно зарядженими полюсами, і на електродах може відбуватися відновлення й окиснення молекули води. У розчинах виникає певна конкуренція між двома однойменно зарядженими йонами щодо участі в окисно-відновних процесах – катіонами металічних елементів і Гідрогену, а також аніонами кислотного залишку і гідроксид-іонами. Участь у процесі електролізу визначається активністю конкуруючих йонів.
Розглянемо правила визначення продуктів, що утворюються на електродах при дисоціації водних розчинів солей.
Продукти відновлення на катоді (табл. 17). Активність катіонів металічних елементів і Гідрогену визначається їх положенням у витискувальному ряді металів (див. § 56). Метали розміщені за зменшенням здатності віддавати електрони. Хімічна активність катіонів – здатність приєднувати електрони – змінюється протилежно: збільшується від початку до кінця ряду. Так, найбільш активним металом є літій, а його йони Li+ – найменш активними. Найменш активний метал – золото, а йони Au3+ є найбільш активними.
Т а б л и ц я 17
Визначення продуктів електролізу водного розчину електролітів на катоді

1. За рівних умов на катоді відновлюються катіони малоактивних металічних елементів, які у витискувальному ряді металів стоять після катіонів Гідрогену H+. Здатність приєднувати електрони у них вища, ніж у катіонів Гідрогену H+, тому останні, як менш активні, залишаються в розчині. Наприклад, при електролізі розчину меркурій(ІІ) хлориду на катоді відновлюються катіони Hg2+ і утворюється ртуть.
– Запишіть рівняння електролізу меркурій(ІІ) хлориду в розчині.
2. За рівних умов на катоді відновлюються йони Гідрогену H+, якщо солі містять катіони металічних елементів, які у витискувальному ряді металів стоять до йонів алюмінію Al3+ включно. Здатність приєднувати електрони в катіонів Гідрогену H+ значно вища, ніж у катіонів зазначених металічних елементів.
Продукти окиснення на аноді. Окиснювальна здатність аніонів так само залежить від їх складу (табл. 18). За зменшенням здатності окиснюватися аніони можна розмістити так:
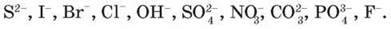
За рівних умов на аноді окиснюються аніони кислотних залишків безоксигенових кислот: S2-, I-, Br-, Cl – (крім F), які легше віддають електрони, ніж гідрооксид-іони OH – води.
Т а б л и ц я 18
Визначення продуктів електролізу водного розчину електролітів на аноді

Розглянемо приклади електролізу розчинів солей. Приклад 1. Електроліз водного розчину натрій хлориду:
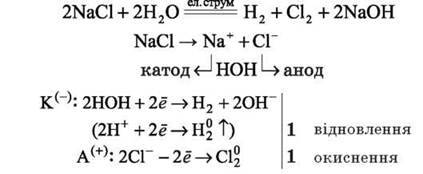
У розчині залишаються два види йонів: катіони Натрію Na+ і гідроксид – іони OH-, які у рівнянні електролізу записуємо формулою NaOH. Приклад 2. Електроліз водного розчину калій сульфіду:
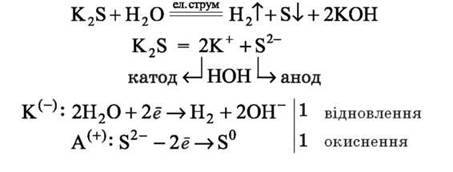

Мал. 95. Срібна прикраса з позолотою
Слід зазначити, що у цьому параграфі розглянуто електроліз на так званих інертних електродах (з графіту, золота, платини), які не беруть участі в процесі електролізу. Електроди з більш активних металів (наприклад, нікелю, міді) окиснюються в процесі електролізу. Їх називають розчинними і застосовують для очищення металів від домішок.
Використання електролізу. Окиснювальна і відновна здатність електричного струму набагато сильніша, ніж у хімічних окисників та відновників. Тому електролізом добувають і найбільш активні метали (калій, натрій, кальцій, магній, алюміній), і менш активні (цинк, мідь, кадмій тощо). Відновлені на катоді метали характеризуються дуже високою чистотою. Застосовують електроліз і для очищення деяких металів від домішок (електролітичне рафінування), наприклад міді, нікелю, свинцю, золота.
Електролізом добувають активні неметали (хлор, фтор) і такі важливі сполуки, як натрій гідроксид, калій гідроксид, калій хлорат, гідроген пероксид.
Електроліз застосовують також для нанесення захисних металічних покриттів на поверхні (гальванопластика) і виготовлення копій рельєфних поверхонь (електрохімічна обробка). Наприклад, хромування деталей машин, золочення ювелірних виробів (мал. 95).
Електролізом стічних промислових вод забезпечується їх очищення від катіонів металів-забруднювачів, які відновлюються на катоді.
Коротко про головне
Електроліз – окисно-відновні процеси, що відбуваються на електродах під час пропускання постійного електричного струму крізь розчин або розплав електроліту.
Катод (K) – негативно заряджений електрод – є відновником, на якому відновлюються катіони металічних елементів і Гідрогену. Анод (A+) – позитивно заряджений електрод – є окисником, на якому окиснюються аніони кислотних залишків і гідроксид-іони. При електролізі водних розчинів електролітів, крім йонів електролітів, у реакції можуть брати участь і катіони Гідрогену H+ та гідроксид-іони OH – води. Склад продуктів, що утворюються в процесі електролізу, визначається хімічною активністю йонів. Сильна окиснювальна і відновна здатність електричного струму зумовлює використання електролізу для добування металів, у тому числі найбільш активних (калію, натрію, кальцію, магнію, алюмінію); активних неметалів (фтору, хлору) та інших сполук; очищення металів від домішок, стічних промислових вод від катіонів металічних елементів-забруднювачів.