Енергія активації
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ.
§ 4.3. Енергія активації
Значну зміну швидкості реакції зі зміною температури пояснює теорія активації. Згідно з цією теорією в хімічну взаємодію вступають тільки активні молекули (частинки), що мають енергію, достатню для здійснення даної реакції. Неактивні частинки можна зробити активними, надавши їм необхідну додаткову енергію, – цей процес називається активацією. Один із способів активації – підвищення
Енергія, яку потрібно надати молекулам (частинкам) реагуючих речовин, щоб перетворити їх на активні, називається енергією активації.
Її визначають експериментально, позначають буквою Eа і звичайно виражають у кДж/моль. Наприклад, для сполуки гідрогену і йоду (Н2 + l2 = 2Нl) маємо Еа = 167,4 кДж/моль, а для розпаду йодоводню (2Нl = Н2 + l2) Eа == 186,2 кДж/моль.
Енергія активації Еа залежить від природи реагуючих речовин і є характеристикою кожної реакції. Ці уявлення пояснюються (рис.
A2 + В2 = 2АВ. Вісь ординат характеризує потенціальну енергію системи, вісь абсцис – хід реакції: початковий стан -> перехідний стан -> кінцевий стан. Щоб речовини А2 і В2, які реагують, утворили продукт реакції АВ, вони мають подолати енергетичний бар’єр С.
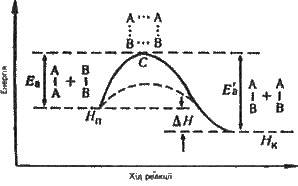
Рис. 4.2. Зміна енергії реагуючої системи:
Нn – енергія початкового стану (вихідні речовини);
Нк – енергія кінцевого стану (продукти реакції);
Еа – енергія активації прямої реакції;
E”а – енергія активації зворотної реакції;
А… А
. .
. . – активований комплекс;
. .
В… В
∆Н – тепловий ефект реакції
На це витрачається енергія активації Espan>а, на значення якої зростає енергія системи. При цьому в ході реакції з частинок реагуючих речовин утворюється проміжне нестійке угруповання, що називаєтся перехідним станом, або активованим комплексом (у точці С), подальший розпад якого зумовлює утворення кінцевого продукту АВ. Механізм реакції можна зобразити схемою:
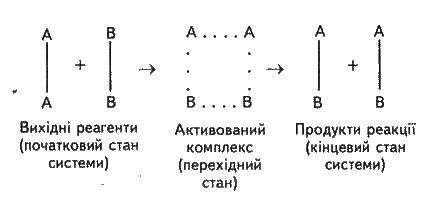
Якщо під час розпаду активованого комплексу виділяється більше енергії, ніж необхідно для активації частинок, то реакція екзотермічна. Прикладом ендотермічної реакції є зворотний процес – утворення з речовини АВ речовин А2 і B2. 2АВ = А2 + В2. У цьому разі процес відбувається також через утворення активованого комплексу А2В2, однак енергія активації більша, ніж для прямого процесу: E’а = Eа + ∆Н (∆Н – тепловий ефект реакції). Для перебігу ендотермічних реакцій необхідно підводити енергію ззовні.
Як видно з рис. 4.2, різниця енергій кінцевого стану системи (Нк) і початкового (Nп) дорівнює тепловому ефекту реакції (див. § 1.8):
∆Н = Нк – Нп.
Швидкість реакції залежить безпосередньо від значення енергії активації: якщо воно мале, то за певний час перебігу реакції енергетичний бар’єр подолає значна кількість частинок, і швидкість реакції буде високою, але якщо енергія активації велика, то реакція відбувається повільно.
Під час взаємодії іонів енергія активації дуже мала й іонні реакції відбуваються дуже швидко (практично миттєво).