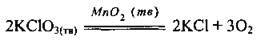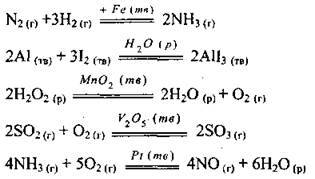Швидкість хімічної реакції. Каталізатор – Хімічна реакція
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
4. Хімічна реакція
4.8. Швидкість хімічної реакції. Каталізатор
Розділ хімії, що вивчає швидкість хімічних реакцій, називають хімічною кінетикою. Розгляньмо зміст деяких понять, які використовують у цьому розділі.
Швидкість хімічних реакцій характеризується зміною концентрації реагентів (або продуктів реакції) за одиницю часу.
Якщо реакції відбуваються в однорідному середовищі (наприклад, реакції між газами або рідинами),
У другому випадку реакції відбуваються на поверхні стикання речовин, яку називають поверхнею розділу фаз. Фаза – це частина системи, яка відділяється, від інших частин системи поверхнею поділу.
Швидкість гомогенної реакції визначається кількістю речовини, яка вступила в реакцію або утворилася внаслідок реакції за одиницю часу в одиниці об’єму:
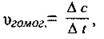
Де vгомог. – швидкість реакції в гомогенній системі, моль/с·м3 або моль/с·л;
Δс – зміна концентрації, моль/м3, моль/л;
Δt
Швидкість гетерогенної реакції визначається кількістю речовини, яка вступила в реакцію або утворилася внаслідок реакції за одиницю часу на одиниці поверхні розділу фаз:
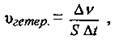
Де vгетер. – швидкість реакції в гетерогенній системі, моль/м2·с;
Δv = v1 – v2 – зміна кількості речовини, моль;
S – площа розділу фаз, м2;
Δt – інтервал часу, с.
Швидкість хімічної реакції залежить від різних факторів:
1) від природи реагентів. Наприклад, метали реагують із хлоридною кислотою з різною швидкістю: магній швидше, ніж залізо, а мідь не реагує взагалі:
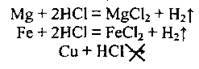
Галогени реагують з воднем з різною швидкістю: хлор швидше за йод;
2) від концентрації реагентів (для речовин у рідкій та газоподібній фазі). Наприклад, реакція окиснення нітроген(ІІ) оксиду чистим киснем відбувається швидше, ніж реакція окиснення киснем повітря:
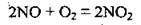
У 1865 р. М. М. Бекетов, а у 1867 р. К. Гульдберг і П. Вааге встановили кількісну залежність швидкості реакції від концентрації речовин, що реагують. Ця залежність виражається законом діючих мас: швидкість хімічної реакції у кожний момент часу пропорційна добутку концентрацій реагентів.
Для простих одностадійних реакцій концентрації речовин підносять до ступеня, який визначається стехіометричним коефіцієнтом реагенту. Наприклад, для реакції
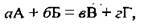
Де а, б, в, г – коефіцієнти,
A, Б – формули реагентів,
B, Г – формули продуктів реакції,
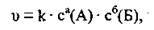
Де v – швидкість реакції,
Сa(А), сб(Б) – молярні концентрації реагентів А і Б,
А, б – коефіцієнти,
K – константа швидкості.
Цей вираз називають кінетичнім рівнянням. Нагадаємо, що в кінетичні рівняння вводять лише концентрації речовин, які перебувають у газоподібному і рідкому станах. Наприклад:
А) для реакції
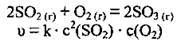
Б) для реакції
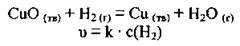
3) від площі поверхні реагентів (коли один з реагентів перебуває у твердій фазі). Реакції відбуваються швидше, якщо площа поверхні речовин, які реагують, більша. Площі контакту речовин збільшують, подрібнюючи твердий реагент. Наприклад, цукор (цукор-пісок або шматочок рафінаду) горить лише у полум’ї, а цукрова пудра спалахує від іскри1;
4) від температури – правило Вант-Гоффа2: з підвищенням температури на кожні 10 °С швидкість більшості хімічних реакцій збільшується у 2-4 рази:
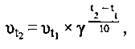
Де vt2 – швидкість реакції за температури t2,
Vt1 – швидкість реакції за температури t1,
Γ – температурний коефіцієнт (γ = 2…4).
Навіть невелике підвищення температури викликає різке збільшення швидкості реакції. Це пояснюється тим, що взаємодіяти можуть лише ті частинки, енергія яких буде достатньою для послаблення чи розриву хімічних зв’язків у вихідних речовинах. Такі частинки називають активними. При підвищенні температури кількість активних частинок зростає, відповідно зростає і швидкість реакції. Наприклад, залізо з хлором за кімнатної температури реагує повільно, а за високих температур іде бурхлива реакція; водень вступає в реакцію з оксидами металічних елементів лише під час нагрівання:
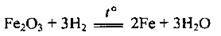
5) від наявності каталізатора – речовини, яка змінює швидкість хімічної реакції (але сама при цьому не витрачається).
Так, синтез аміаку з азоту та водню відбувається лише за наявності заліза зі спеціальними домішками:
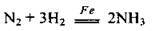
Реакція окиснення аміаку киснем відбувається лише за наявності платини:
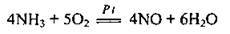
Хімічні реакції, які відбуваються за участі каталізаторів, називають каталітичними, а саме явище зміни швидкості реакції за наявності каталізатора – каталізом3.
Одні речовини збільшують швидкість реакції (позитивний каталіз), їх називають каталізаторами. Інші речовини зменшують швидкість реакції (негативний каталіз), їх називають інгібіторами. Більшість хімічних реакцій, які відбуваються у природі, є каталітичними. Найбільш відомим і поширеним каталізатором є вода. Живі системи використовують біологічні каталізатори, які мають білкову природу; їх називають ферментами (ензимами).
Розрізняють гомогенний і гетерогенний каталіз.
Гомогенний каталіз відбувається за наявності каталізатора, який перебуває в такому ж агрегатному стані (в одній фазі), що й реагенти (рідкому або газоподібному). Про гетерогенний (контактний) каталіз говорять тоді, коли реагенти і каталізатор перебувають у різних агрегатних станах, тобто у різних фазах (каталізатор зазвичай твердий, а реагенти – рідкі чи газоподібні).
Гомогенний каталіз | Гетерогенний каталіз |
|
|
Вважають, що каталізатор утворює з реагентами проміжні сполуки. Наприклад, реакція
А + В = АВ
Без каталізатора відбувається дуже повільно. Якщо використати каталізатор К, то він вступить у реакцію з одним з реагентів, утворивши проміжну сполуку АК:
А + К = АК,
Яка є значно активнішою за речовину А і легко взаємодіє з речовиною В:
АК + В = АВ + К
Таким чином каталізатор не входить до складу кінцевих продуктів реакції, а отже, його кількість залишається незмінною.
_____________________________________________________________________
1 Здатні до окиснення речовини, подрібнені на порошок, є вибухонебезпечними: борошно, вугільний пил та ін. можуть мимовільно (за умов відсутності іскри або відкритого полум’я) спалахувати та вибухати.
2 Емпіричне правило, яке на основі багатьох експериментів вивів голландський хімік Якоб Хендрік Вант-Гофф (1852-1911), перший лауреат Нобелівської премії з хімії, 1901 р. Правило діє лише у неширокому температурному діапазоні (від 0 до 100 °С).
3 Термін “каталіз” увів 1835 р. шведський хімік Йонс Якоб Берцеліус (1779-1848).