Силікатна кислота й силікати. Поняття про будівельні матеріали: скло, цемент, бетон
ІІ семестр
Тема 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (продовження)
УРОК 20
Тема уроку. Силікатна кислота й силікати. Поняття про будівельні матеріали: скло, цемент, бетон
Цілі уроку: ознайомити зі складом і властивостями силікатної кислоти й силікатів; з’ясувати сфери їх використання, істотні відмінності від інших кислот за фізичними й хімічними властивостями; ознайомити із силікатами як найважливішими будівельними матеріалами, що виробляє силікатна промисловість, – склом, цементом, бетоном; охарактеризувати можливості
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: навчальна лекція, фронтальна й самостійна робота з опорною схемою.
Обладнання: зразки будівельних матеріалів, кераміки, скла, лабораторне устаткування, колекція будівельних матеріалів.
Лабораторний дослід 8. Ознайомлення
ХІД УРОКУ
I. Організація класу
II. Мотивація навчальної діяльності,
Перевірка домашнього завдання
Силікатна кислота й силікати
Вступне слово вчителя
H2SiO3 – дуже слабка кислота, нерозчинна у воді. Одержують її в один спосіб – діючи на розчини її солей кислотами:
Na2SiO3 + 2HCl  2NaCl + H2SiO3
2NaCl + H2SiO3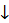 (колоїдний розчин)
(колоїдний розчин)
Згадаймо з 9 класу, що таке колоїдний розчин.
Силікати – безбарвні, тугоплавкі речовини, нерозчинні у воді (розчиняються лише Na2SiO3 й K2SiO3).
Силікати дуже поширені в природі.
Назвіть природні сполуки – силікати. (Польовий шпат, слюда, глини, азбест, тальк, коштовні камені – смарагд, топаз, аквамарин, рідке скло – Na2SiO3 – K2SiO3)
Якісна реакція на силікати – дія кислот (при цьому випадає колоїдний осад H2SiO3).
Сполуки Силіцію відіграють важливу роль у народному господарстві. Кремнезем і природні силікати служать вихідними матеріалами у виробництві скла, керамічних виробів, порцеляни й фаянсу, будівельних і в’язких матеріалів. Усі ці виробництва складають велику галузь народного господарства – силікатну промисловість.
Скло одержують з білого піску, вапняку й соди шляхом сплавлення суміші. Приблизний склад: Na2CaSi6O14, або Na2O – CaO – 6SiO2. У разі заміни Na2SiO3 на K2SiO3 одержують тугоплавке скло для хімічного посуду. Якщо замінити СаО на РbО, а Na2O – на K2O, можна одержати штучний кришталь K2O – PbO – 6SiO2.
Цемент одержують шляхом прожарювання суміші глини Al2O3 – 2SiO2 – 2H2O і вапняку CaCO3. Після виділення вуглекислого газу й води залишається Al2O3 – 2SiO2 – CaO – цемент.
Бетон – цемент + наповнювач (пісок або щебінь).
ІІІ. Вивчення нового матеріалу
Повідомлення учнів про силікати й будівельні матеріали
1. Силіцій оксид SiO2 – тверда, дуже тугоплавка речовина (температура плавлення – понад 1 700 °С), дуже поширена в природі, де вона трапляється головним чином у вигляді мінералу кварцу, а також кристобаліту й тридиміту.
За звичайних температур стійкою модифікацією є кварц, з підвищенням температури спостерігаються поліморфні перетворення:
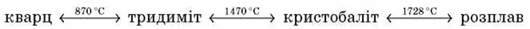
Кварц трапляється в природі у формі правильних кристалів, іноді значної величини. Кристали утворюються з тетраедрів, розташованих гвинтоподібно навколо центральної осі, у вигляді спіралі. У тому самому кристалі напрямок спіралі може бути протилежним.
Кварц використовується в різних галузях науки й техніки, і його кристали часто вирощуються штучно. Деякі різновиди кварцу мають власні назви. Прозорі безбарвні кристали називають гірським кришталем. Трапляються й забарвлені різновиди кварцу: рожевий кварц, фіолетовий (аметист), темно-коричневий (димчастий топаз), зелений (хризопраз) та ін. Дрібнокристалічна модифікація кварцу з домішками інших речовин називається халцедоном. Різновидами халцедону є агат, яшма та ін. Гірський кришталь і забарвлені різновиди кварцу використовують як коштовне й напівкоштовне каміння.
Тридиміт міститься у вулканічних породах, однак у дуже незначних кількостях. Відомий тридиміт і метеоритного походження.
Кристобаліт у природі іноді трапляється у вигляді дрібних кристалів, включених у лаву, подібно до тридиміту. Тридиміт і кристобаліт мають більш “рихлу” структуру, ніж кварц.
Розплав кремнезему в результаті повільного остигання легко утворює аморфне кварцове скло. Кремнезем у формі скла трапляється й у природі. Густина аморфного скла дорівнює 2,20 г/см3 – менша, ніж у всіх кристалічних модифікацій. Кварцове скло має незначний температурний коефіцієнт розширення, тому з нього виготовляють лабораторний посуд, стійкий до різких змін температури.
2. Оксид Si02 є ангідридом ряду силікатних кислот, склад яких можна описати загальною формулою xSiO2 – yH2O. Кислоти, молекули яких містять більш ніж одну молекулу SiO2, належать до полісилікатних.
Найпростіша із силікатних кислот – H2SiO3. її часто називають просто силікатною, а її солі – силікатами. Із силікатів у воді розчиняються лише силікати Натрію й Калію, решта силікатів – тугоплавкі, нерозчинні у воді речовини.
Розчини силікатів каламутніють унаслідок перебування на повітрі, оскільки СO2, що міститься в них, витісняє силікатну кислоту з її солей (H2SiO3 слабша за карбонатну кислоту).
H2SiO3 практично не розчиняється у воді, і цю властивість використовують як якісну реакцію для виявлення силікат-іонів:
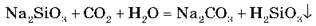
Одержують силікати шляхом сплавлення SiO2 з лугами або карбонатами.
Концентровані розчини силікатів Натрію й Калію називають рідким склом. Вони мають сильнолужну реакцію внаслідок того, що дуже гідролізовані:
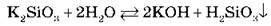
Рідке скло використовують, наприклад, для виготовлення клею, водонепроникних тканин.
3. Скло
У результаті нагрівання сумішей багатьох силікатів один з одним або із кремнеземом одержують прозорі аморфні сплави, що називаються склом. Скло є аморфним, воно не має кристалічного порядку. Через цю особливість воно переходить у рідкий стан не стрибком, а поступово.
Головна властивість будь-якого скла, що відіграє головну роль у виробництві скляних виробів, полягає в тому, що в розплавленому стані, остигаючи, воно не відразу твердне, а поступово густіє, робиться грузлим і зрештою перетворюється на тверду однорідну прозору масу.
Багато інших властивостей скла значною мірою залежать від його складу. Змінюючи не лише складові скла, але і їхні відносні кількості, можна одержувати види скла, що мають дуже різні властивості.
Звичайне скло для шибок, а також скло, з якого виготовляється переважна частина скляного посуду для домашнього вжитку, – пляшки, склянки тощо, складається, головним чином, із силікатів Натрію й Кальцію, сплавлених із кремнеземом. Склад такого скла приблизно можна описати формулою Na2O – CaO – 6SiO2. Вихідними матеріалами для його одержання є не власне силікати, а білий пісок, сода й крейда.
Суміш цих речовин сплавляють у регенеративних печах, які зазвичай нагріваються з допомогою генераторного газу. Під час плавлення протікають такі реакції:
CaCO3 + SiO2 = CaSiO3 + CO2
Na2CO3 + SiO2 = Na2SiO3 + CO2
Часто соду заміняють натрій сульфатом і вугіллям. Вугілля відновлює Na2SO4 до Na2SO3, який, вступаючи в реакцію з піском, утворює Na2SiO3:
2Na2SO4 + 2SiO2 + C = 2Na2SiO3 + 2SO2 + CO2
Скляні вироби виготовляються шляхом видування, лиття, пресування й витягування. Видування скляних виробів ще донедавна здійснювалося виключно силою легенів майстра й було дуже важкою працею. Але останнім часом техніка склоробства зробила чималий крок уперед, і наразі існують машини, що механічно виготовляють найпростіші скляні предмети, наприклад пляшки, а також машини для безпосереднього одержання листового скла шляхом витягування з в’язкої скломаси нескінченної скляної стрічки.
Якщо під час “варіння” скла замінити соду поташем, то можна одержати так зване богемське скло, що складається із силікатів Калію й Кальцію. Воно більш тугоплавке, ніж звичайне скло для шибок, і застосовується для особливого сорту хімічного посуду, здатного витримувати значні температури. У результаті сплавлення кремнезему з поташем і плюмбум оксидом одержують світле важке скло, що називається кришталем і містить силікати Калію та Плюмбуму. Таке скло має значну здатність переломлювати світлові промені й після шліфування набуває сильного блиску; з нього виробляють оптичні види скла й художній посуд.
Великий вплив на властивості скла має заміна частини кремнезему борним ангідридом B2O3, що підвищує твердість скла, робить його більш стійким щодо хімічних впливів і менш чутливим до різких змін температури. З такого скла виготовляється високоякісний хімічний посуд.
Застосовуваний під час варіння звичайного скла пісок часто містить домішки сполук Феруму, які надають склу некрасивого зеленого забарвлення. Найкращим способом його знищення є додавання до маси, що сплавляється, незначних кількостей Селену, який дає рожеве забарвлення. Додаткові кольори (рожевий і зелений) разом дають білий. Аналогічно діє й манган(IV) оксид.
Іноді до скляної маси, що сплавляється, спеціально додають ті чи інші речовини для одержання забарвленого скла. Наприклад, хром(ІІІ) оксид Cr2O3 надає склу зеленого забарвлення, манган(IV) оксид – червонясто-лилового, кобальт(ІІ) оксид – синього тощо. У більшості випадків колір скла залежить від утворення забарвлених силікатів (Феруму, Мангану, Кобальту та ін.). Але іноді він виникає через те, що додана речовина міститься в склі в надзвичайно дрібному стані. Так, унаслідок додавання незначної кількості золота скло набуває рубіново-червоного кольору, зумовленого наявністю в склі дрібних, не помітних навіть у мікроскоп, часток золота, що виділяються під час повільного остигання розплавленого скла. рубінові види скла пропускають лише червоні промені й тому застосовуються у фотографічних процесах, що вимагають червоного освітлення.
Скло зазвичай зараховують до речовин, що не розчиняються у воді. Однак унаслідок її тривалої дії на звичайне натрієве скло вода частково вимиває з нього натрій силікат.
4. Кераміка
Під керамікою, або керамічною промисловістю, розуміють виробництво різних виробів із глини. Кераміка охоплює виробництво цегли, черепиці, вогнетривких матеріалів, гончарного посуду, гончарних труб, кахлів (груба кераміка), а також виробництво порцеляни й фаянсу (тонка кераміка). Усі ці виробництва грунтуються на здатності глини давати з водою пластичне тісто, яке після випалювання перетворюється на тверду пористу масу, що не розмокає у воді.
Для підвищення механічної міцності виробів до глини додають різні речовини, з яких головними є кварц і польовий шпат.
Керамічні вироби формують із вологої глини механічним шляхом або вручну на гончарних верстатах, потім висушують на повітрі або в спеціальних сушарках і обпалюють у печах. У процесі випалювання випаровується вода – як та, на якій було замішано глину, так і та, що входить до складу молекул глини, унаслідок чого глина стає пористою, трохи спікається й перетворюється на алюміній силікат 3Al2O3 – 2SiO2.
Низькосортні керамічні вироби: цеглу, дренажні труби, черепицю, квіткові горщики тощо, виготовляють на цегельних заводах з низькосортних глин. їх випалюють за відносно низької температури (не вище від 1 000 °С), вони пористі й можуть усмоктувати чимало води.
Так само виготовляється простий гончарний посуд. Щоб зробити посуд водонепроникним, його покривають глазур’ю. Для цього у випалювальну піч кидають кухонну сіль, пари якої вступають у реакцію з частиною кремнезему, що міститься у виробах, і останні покриваються склоподібним шаром легкоплавкого силікату.
Найкращі сорти кераміки й фаянс виробляють із більш чистих сортів глини, що не містять Феруму, і випалюють за більш високої температури.
5. Цемент
Одним з найважливіших матеріалів, що виготовляє силікатна промисловість, є цемент, споживаний у величезних кількостях у будь-яких будівельних роботах.
Цемент одержують шляхом прожарювання глини з вапняком CaCO3. Для цього названі речовини попередньо ретельно перемішуються в сухому або сирому вигляді, а потім піддають сильному випалюванню.
Під час випалювання цементної суміші кальцій карбонат розкладається на вуглекислий газ і кальцій монооксид, що вступає в реакцію з глиною, причому продуктами реакції є силікати й алюмінати Кальцію. Випал цементу наразі здійснюється в особливих обертових циліндричних печах.
Хімічний склад цементів зазвичай виражають у відсотках оксидів, що містяться в них, з-поміж яких головними є СаО, Al2O3, SiO2 і Fe2O3. Масове співвідношення кальцій оксиду до інших трьох оксидів називається гідромодулем цементу й характеризує його технічні якості.
Цемент дуже широко використовується в будівництві як в’язкий матеріал, що після змішування з водою твердне. Зазвичай цемент одержують у великих обертових печах, де здійснюють випал і розмел різних силікатів (за температури 1000 °С).
Розрізняють кілька типів цементів, однак умовно можна виділити два типи цементів за принципом їх “схоплювання” – звичайний цемент і портландський цемент. Процес “схоплювання” звичайного цементу, що складається з кальцій силікату, відбувається внаслідок утворення кальцій карбонату за рахунок вуглекислого газу повітря:
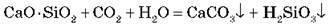
Під час схоплювання портландського цементу вуглекислота не бере участі в процесі, а відбувається гідроліз силікатів з наступним утворенням нерозчинних кристалогідратів:
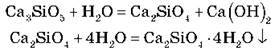
IV. Підбиття підсумків уроку
Як ви розумієте висловлювання М. В. Артемонова: “Світ навколо нас – величезна експозиція сфер застосування скла”?
Які будівельні матеріали ви знаєте?
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Творче завдання: підготуватися до семінару з теми “Використання неметалів та їхніх сполук, кругообіг неметалів у природі” (повідомлення, презентації, плакати).