Способи кількісного вираження складу розчинів – РОЗЧИНИ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
РОЗЧИНИ
Способи кількісного вираження складу розчинів
Для кількісного опису складу розчину часто вживають величини: масова частка розчиненої речовини й молярність розчину. Окрім цих, є й менш популярні способи: мольна частка, моляльність, нормальність, титр, об’ємна частка тощо. Способів вираження концентрації досить багато, тому що в цій ролі можна використати відношення якої-небудь величини, що характеризує розчинену речовину (маса, об’єм,
Масова частка розчиненої речовини (ω) – це величина, що дорівнює відношенню маси розчиненої речовини до маси розчину.
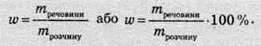
Масова частка – величина безрозмірна й зазвичай виражається у відсотках.
Мольна частка (χ) – це величина, що дорівнює відношенню кількості розчиненої речовини до сумарної кількості речовини розчинника та розчиненої речовини.
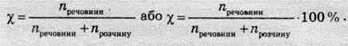
Молярність розчину (С) – це величина, що дорівнює відношенню кількості
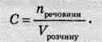
Одиниця виміру молярності розчину – моль/л. Позначається С = 1 моль/л; С = 0,02 моль/л або С = 1 М; С = 0,02 М. Молярність розчину часто називають також молярною концентрацією.
Моляльність розчину (Сm або m) – це величина, що дорівнює відношенню кількості розчиненої речовини до маси розчинника, вираженої в кілограмах.
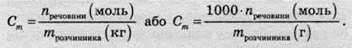
Одиниця виміру моляльності розчину – моль/кг або моль/1000г. Моляльність розчинів не залежить від температури розчину, на відміну від молярності чи нормальності, тому що маса розчинника (або розчину), на відміну від об’єму, не залежить від температури навколишнього середовища. Завдяки цьому такий спосіб вираження концентрації розчинів дуже часто використовують при дослідженнях в області фізичної хімії, особливо в тих, де необхідно досліджувати температурні залежності.
У зв’язку з кількісним описом складу розчину також часто вживають терміни концентрований та розведений розчин. Поняття концентрований та розведений розчин не має жодної кількісної характеристики. Найчастіше розчин, в якому менше 10% розчиненої речовини, називають розведеним, а якщо більше 50% – концентрованим.