АМОРФНІ ТІЛА
Розділ 2. БУДОВА РЕЧОВИНИ
§12 . ТВЕРДІ ТІЛА
3. АМОРФНІ ТІЛА
Аморфні тіла ви також бачите щодня: так, аморфними тілами є скляні предмети (рис. 12.9).
Аморфні тіла мають плинність, але значно меншу, ніж рідини. Плинність аморфних тіл зростає з підвищенням температури, завдяки чому, наприклад, із краплі нагрітого скла можна “видувати” скляні посудини подібно до того, як видувають мильні бульбашки. На рис. 12.10 зображено краплю “напіврідинного” скла.

Досліди свідчать, що скло має деяку плинність
Плинність аморфних тіл зумовлена тим, що в аморфних тілах немає кристалічних граток.
На рис. 12.11 схематично зображено молекулярну будову аморфного тіла. Вона нагадує молекулярну будову рідини, тому аморфні тіла посідають проміжне положення між рідинами та кристалами.
Через відсутність кристалічної гратки атоми або молекули в аморфних тілах час від часу “перескакують” з одного положення в інше.
Це й пояснює плинність
ЧОМУ ГРАФІТ – М’ЯКИЙ, А АЛМАЗ ТВЕРДИЙ?
Властивості кристала залежать не тільки від типу атомів, а й від типу кристалічних граток.
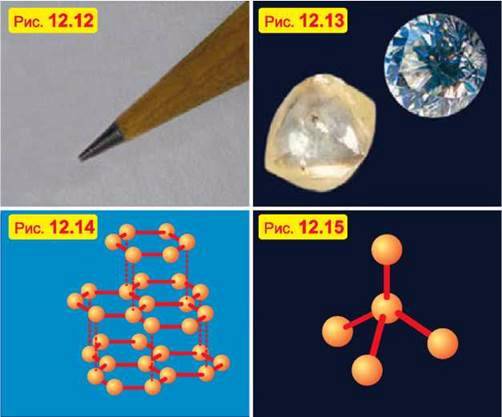
Важко повірити, наприклад, що м’який чорний графіт, з якого зроблено стрижні олівців (рис. 12.12), і твердий прозорий алмаз (рис. 12.13) складаються з однакових атомів – атомів Карбону.
Чому ж тоді ці дві речовини так відрізняються за своїми властивостями?
Річ у тім, що кристалічні гратки графіту мають шарувату структуру, причому сусідні шари слабко зв’язані один з одним (рис. 12.14). Тому шари легко відокремлюються один від одного, що й пояснює м’якість графіту.
1 Тому такі тіла й називають аморфними: від грецького “аморфос” – що не має форми.
У кристалічних же гратках алмазу всі атоми сильно зв’язані зі своїми найближчими сусідами (рис. 12.15). Саме цей жорсткий зв’язок атомів і зумовлює унікальну твердість алмазу.
РІДИННІ КРИСТАЛИ
У другій половині 20-го століття почали активно вивчати й застосовувати штучно створені речовини, які поєднують властивості рідин і кристалів. Їх назвали рідинними кристалами1.
Широке застосування рідинних кристалів зумовлено тим, що вони дуже чутливі до зміни зовнішніх умов: наприклад, навіть за невеликої зміни температури або тиску вони можуть змінювати свій колір. Завдяки цьому рідинні кристали широко застосовують у різних приладах – наприклад, у рідиннокристалових2 медичних термометрах. Особливо широко застосовують рідинні кристали для виготовляння різних дисплеїв – від годинників і мобільних телефонів до комп’ютерів і телевізорів.
1 Раніше їх називали рідкими кристалами.
2 Раніше їх називали рідкокристалічними.
У розташуванні молекул рідинних кристалів є певна впорядкованість, тому ці речовини називають рідинними кристалами. Але вони не мають кристалічних граток, тому ці речовини називають рідинними кристалами.
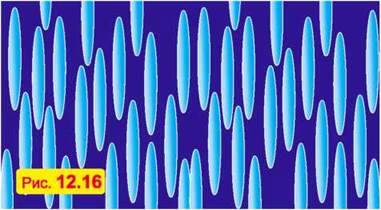
Наприклад, молекули рідинних кристалів часто мають витягнуту форму – довжина молекули може в десять і більше разів перевищувати її “товщину”. Причому ці витягнуті молекули зорієнтовані однаково (наприклад, розташовані переважно вертикально), але центри молекул розташовані хаотично. На рис. 12.16 схематично зображено молекулярну будову такого рідинного кристала.
ГОЛОВНЕ В ЦЬОМУ РОЗДІЛІ
– Усі тіла навколо нас складаються з атомів.
– За атомну одиницю маси (а. о. м.) прийнято 1/12 маси атома Карбону.
– Молекули складаються з атомів.
– Властивості речовини визначає тип її молекул, тому молекула є найдрібнішою частинкою речовини.
– Характерною довжиною у світі атомів і молекул є 0,1 нм.
– Дослідним підтвердженням молекулярної будови речовини й хаотичного руху молекул є броунівський рух.
– З підвищенням температури швидкість хаотичного руху молекул збільшується.
– Дифузією називають взаємне проникнення частинок однієї речовини в іншу, спричинене рухом молекул. Дифузія є дослідним підтвердженням руху молекул.
– Молекули взаємодіють між собою: на дуже малих відстанях молекули відштовхуються, а на трохи більших – притягуються.
– Основні положення молекулярно-кінетичної теорії: 1) усі речовини складаються з крихітних частинок – атомів і молекул; 2) частинки речовини безперестанно та хаотично рухаються; 3) частинки речовини взаємодіють між собою.
– Речовина може перебувати в трьох станах: твердому, рідинному чи газоподібному. Ці стани речовини називають агрегатними станами.
– Газ займає весь наданий йому об’єм.
– Гази, нагріваючись, розширюються.
– Рідина набуває форми посудини, у якій вона перебуває. Причиною цього є плинність рідини.
– Рідини мають малу стисливість (зберігають свій об’єм).
– На межі з повітрям рідина утворює вільну поверхню.
– Молекули в рідині розташовано впритул, але в цьому розташуванні немає певного порядку.
– Густиною р речовини називають відношення маси m однорідного зразка певної речовини до об’єму цього зразка V, тобто р = m/V. Густина характеризує речовину, а не тіло.
– Тверді тіла зберігають об’єм і форму.
– Тверді тіла внаслідок нагрівання розширюються.
– Є два типи твердих тіл – кристалічні та аморфні.
– Атоми або молекули в кристалах розташовані упорядковано, утворюючи кристалічні гратки.
– В аморфних тілах немає кристалічних граток. Молекулярна будова аморфного тіла нагадує молекулярну будову рідини.