Білки – БІОЛОГІЯ КЛІТИНИ
Біологія. Комплексний довідник – підготовка до ЗНО та ДПА
БІОЛОГІЯ КЛІТИНИ
Білки
Білки – це високомолекулярні сполуки, мономерами яких є амінокислоти. Відомо близько 50 тис. білків, кожен з них складається з 20 основних амінокислот. Усі амінокислоти містять карбоксильну групу – СООН, яка виявляє кислотні властивості, та аміногрупу – NH2, яка виявляє основні властивості. Амінокислоти відрізняються одна від одної за будовою частин, які називають радикалами та позначають літерою ї£. Загальна формула амінокислот:

У молекулі білка залишки молекул амінокислот з’єднані один з одним за допомогою ковалентного пептидного зв’язку, який виникає між карбоксильною групою однієї амінокислоти та аміногрупою іншої амінокислоти з виділенням молекули води:
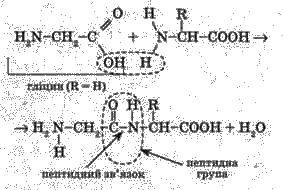
Сполука, що складається з двох залишків амінокислот, являє собою дипептид. Завдяки наявності в дипептиді карбоксильної групи та аміногрупи на кінцях молекули можливе приєднання до неї інших амінокислот. Якщо у такий спосіб з’єднується більше 10 амінокислот, то утворюється поліпептид.
Послідовність амінокислотних
Деякі білки (гемоглобін, велика кількість ферментів вуглеводного обміну) складаються з кількох поліпептидних ланцюгів, які називають субодиницями. У цьому разі після формування третинних структур окремих субодиниць виникає четвертинна структура, що стабілізується гідрофобними взаємодіями, а також іонними та водневими зв’язками.
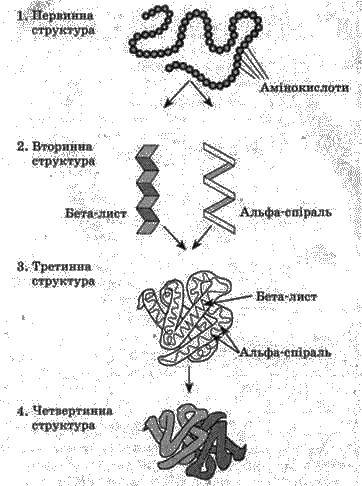
Рис. 1. Рівні структури білків: 1 – первинна, 2 – вторинна, З – третинна, 4 – четвертинна
Одна з основних властивостей білків – здатність змінювати структуру під впливом певних факторів (високої температури та тиску, дії хімічних сполук тощо), при цьому внаслідок розриву водневих і іонних зв’язків порушується третинна та вторинна структура білка. Процес порушення природної структури білка із збереженням його первинної структури називають денатурацією. Внаслідок денатурації змінюються властивості білка: знижується розчинність, втрачається біологічна активність тощо. У разі припинення нетривалої дії факторів, що спричинили денатурацію, можливе відновлення початкової структури білка. Це явище має назву ренатурації.
Функції білків
Функції білків | Приклади білків | Що виконує |
Структурна | Білки є складовою частиною біологічних мембран | |
Колаген | Головний компонент хрящів, сухожилків | |
Еластин | Зв’язки | |
Осеїн | Надає пружності кісткам | |
Кератини | Нігті, пір’я | |
Скоротлива (рухова) | Актин і міозин | Забезпечують здатність м’язів до скорочення |
Тубулін | Входить до складу мікротрубочок, джгутиків, війок | |
Захисна | Полягає у запобіганні пошкодженням клітин, проникненню в організм сторонніх сполук, хвороботворних мікроорганізмів | |
Імуноглобулін | Антитіла | |
Фібриноген, тромбопластин, тромбін | Беруть участь у процесах зсідання крові | |
Сигнальна | Передають сигнали із зовнішнього середовища на інші ділянки мембрани або всередину клітини | Родопсин |
Регуляторна | Гормони | Інсулін, глюкагон |
Гістони | Регуляція активності геному | |
Транспортна | Гемоглобін | Переносить кисень |
Енергетична | Енергетична цінність білків 17,2 кДж | |
Запасаюча | Накопичують запасну речовину | Яєчний альбумін, казеїн – білок молока |
Каталітична | Ферменти |
Ферменти є клітинними каталізаторами біохімічних реакцій. Відомо понад тисячі ферментів. Основу ферменту становлять білки, до них може приєднуватись небілкова частина (вітаміни, метали тощо). Ферменти прискорюють біохімічні процеси в десятки, сотні разів. Ферменти мають такі особливості:
1) каталізують лише певні реакції. Кожна молекула ферменту здатна здійснювати від кількох
Тисяч до кількох мільйонів операцій за хвилину. У ході цих реакцій фермент не втрачає своєї структури і, отже, своєї активності. Фермент просторово сполучається з речовинами, які вступають в реакцію, прискорює їх перетворення і виходить з реакції незмінним;
2) каталітичну активність ферменту зумовлює не вся його молекула, а лише її невелика ділянка – активний центр. Активний центр геометрично відповідає структурі молекул речовин, які вступають у реакцію. Це забезпечує просторове зближення молекул речовин, які вступають у реакцію, та активного центру ферменту, які відповідають один одному як “ключ та замок”;
3) внаслідок денатурації білка, що входить до складу ферменту, його каталітична активність зникає, бо порушується структура активного центру;
4) щоб фермент був активний, потрібна певна кислотність середовища, тобто певна концентрація іонів Гідрогену, і певна температура;
5) для ферментів як у клітині, так і в організмі в цілому характерна закономірна локалізація, оскільки процес розщеплення або синтезу будь-якої речовини в клітині або в організмі поділений на ряд хімічних операцій, які закономірно йдуть одна за одною. Кожну з цих операцій каталізує свій фермент. Група ферментів, які каталізують ланцюг таких хімічних реакцій, є ніби своєрідним біохімічним конвеєром.
ЦЕ ЦІКАВО
Ще на початку XIII ст. було встановлено, що речовини, які містяться в соках рослин та екстрактах тваринних тканин, мають однакову природу. Вперше почав вивчати хімію білкових речовин Я. Бекаррі. У 1728 р. він виділів із пшеничного борошна білок-клейковину і дослідив деякі його властивості. У той самий час білки вивчав і французький учений А. Фуркруа. Він грунтовно дослідив білки сироватки крові та назвав її три компоненти – желатин, альбумін, фібрин. У1839 р. голландський хімік Г. Мульдер назвав білки протеїнами (від гр. І рrоtоs – перший).
