Будова електронних оболонок атомів
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ
§ 2.6. Будова електронних оболонок атомів
Тепер розглянемо будову окремо взятого електронного рівня (шару). Починаючи із значення головного квантового числа n = 2, енергетичні рівні (шари) поділяються на підрівні (підшари), що відрізняються один від одного за енергією зв’язку з ядром.
Число підрівнів дорівнює головному квантовому числу, але не може бути більше чотирьох: 1-й рівень
Таблиця 2.1. Головне квантове число, типи й число орбіталей і максимальне число електронів на підрівнях і рівнях
Енергетичний рівень п | Число підрівнів, що дорівнює n | Орбіталь | Число орбіталей | Максимальне число електронів | ||
На підрівні | На рівні, Що дорівнює N | На підрівні | На рівні | |||
К (n = 1) | 1 | 1s | 1 | 1 | 2 | 2 |
L (n = 2) | 2 | 2s | 1 | 4 | 2 | 8 |
2p | 3 | 6 | ||||
М(n = 3) | 3 | 3s | 1 | 2 | ||
Зр | 3 | 9 | 6 | 18 | ||
3d | 5 | 10 | ||||
N (n = 4) | 4 | 4s | 1 | 2 | ||
4р | 3 | 6 | ||||
4d | 5 | 16 | 10 | 32 | ||
4f | 7 | 14 |
На кожній орбіталі може перебувати не більше двох електронів – принцип Паулі. Якщо на орбіталі перебуває один електрон, то він називається неспареним, якщо два, то це – спарені електрони. Принцип Паулі пояснює формулу N = 2n. І дійсно, якщо, наприклад, на третьому рівні (n = 3) міститься 32=9 орбіталей, а на кожній орбіталі – по 2 електрони, то максимальне число електронів становить 2 ∙ 32 = 18.
У табл. 2.1 для перших чотирьох рівнів показано зв’язок головного квантового числа n з числом підрівнів, типом і числом орбіталей та з максимальним числом електронів на підрівні і рівні, а на рис. 2.3 наведено схему поділу енергетичних рівнів на підрівні. З таблиці випливає,
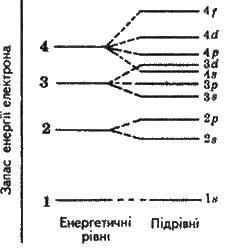
Рис. 2.3. Схема поділу енергетичних рівнів на підрівні
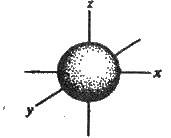
Рис. 2.4. Форма s-електронної орбіталі
Що для характеристики електронів в атомі потрібно знати номер електронного рівня і типи орбіталей. Важливо знати форму різних орбіталей (хмар). Це необхідно при вивченні структури молекул. Згідно з теоретичними даними s-орбіталь має сферичну симетрію, тобто форму кулі. Прикладом може бути орбіталь атома гідрогену, n = 1 (рис. 2.4). Таку орбіталь називають s-орбіталлю. Електрон, який перебуває на s-орбіталі, називається s-електроном.
На другому енергетичному рівні (n = 2) є 4 орбіталі, причому одна з них має сферичну симетрію. Вона називається 2s-орбіталлю. Очевидно, 2s-електрон має вищу енергію, а тому буде перебувати далі від ядра, ніж 1s-електрон. Взагалі, для кожного значення n існує одна симетрична орбіталь.
Р-Орбіталь має форму гантелі, або об’ємної вісімки (рис. 2.5). Усі три р-орбіталі розміщені в атомі взаємно перпендикулярно. Вони напрямлені вздовж осей просторових координат, тому їх часто позначають як рх-, pу – і рz – орбіталі. Таке позначення вказує на просторову напрямленість р-орбіталей. Якщо рх-орбіталь розміщена в напрямку осі х, то, очевидно, pх-електрон з найбільшою ймовірністю буде перебувати поблизу осі х. Те саме можна сказати і про орбіталі ру та pz.
Слід зазначити, що кожний енергетичний рівень (шар), починаючи з n=2, має три р-орбіталі. Із збільшенням n-електрони займають р-орбіталі, розташовані на більших відстанях від ядра, але напрямленість їх по осях х, у, z завжди зберігається. Ще складніші форми, ніж р-орбіталі, мають d-орбіталі (їх п’ять) і f-орбіталі (їх сім). Тут вони не розглядаються.
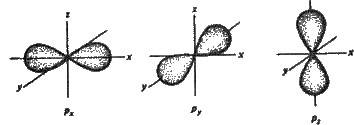
Рис. 2.5. Форма та орієнтація р-електронних орбіталей