Будова електронних оболонок атомів і структура Періодичної системи
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
БУДОВА АТОМА
Будова електронних оболонок атомів і структура Періодичної системи
Число хімічних елементів у періодах
Структура Періодичної системи повністю обумовлюється принципами будови електронної оболонки атомів. Число хімічних елементів, що містяться в кожному періоді, визначається місткістю відповідних енергетичних шарів. Число орбіталей на кожному енергетичному рівні визначається за формулю n2, де n – номер енергетичного рівня.
Перший енергетичний рівень може містити максимально два електрони, тому перший період складається лише з двох елементів – Гідрогену та Гелію. В атомі Гелію перший енергетичний рівень завершений.
В атомах усіх елементів другого періоду перший енергетичний рівень також завершений і поступово заповнюється другий енергетичний рівень. Він може містити не більше восьми електронів (2 ∙ 22 = 8), тому другий період включає вісім хімічних елементів. В атомі Неону, елемента, що завершує
В атомах хімічних елементів третього періоду відбувається заповнення електронами третього енергетичного рівня (n = 3); він може максимально містити 18 електронів (2-32 =18). Однак у третьому періоді всього вісім елементів. Це пояснюється тим, що на зовнішньому рівні не може перебувати більше восьми електронів. Заповнення третього енергетичного рівня до 18 електронів відбувається в атомах елементів четвертого періоду, де цей рівень уже не буде зовнішнім.
В атомі Аргону, що завершує третій період, повністю “заселені” електронами 3s – і 3р-підрівні, а 3d-підрівень залишається вільним. Третій рівень іще не завершений.
У четвертому періоді в атомах перших двох елементів – Калію та Кальцію – електрони заселяють четвертий енергетичний рівень (4s-підрівень), а потім у наступних десяти елементів від скандію до цинку завершується заповнення третього енергетичного рівня (3d-підрівня). За рахунок цього четвертий період уже містить 18 хімічних елементів. Незважаючи на те, що четвертий енергетичний рівень може містити максимально 32 електрони (2 ∙ 42 = 32), повністю він може заповнитися тільки в елементів шостого періоду. Завдяки цьому шостий і сьомий періоди вже містять по 32 елементи.
Класифікація хімічних елементів
Атомні орбіталі поділяють за типами на s, р, d та f. За цим же принципом можна класифікувати й хімічні елементи. Якщо в атомах хімічного елемента останнім заповнюється s-підрівень, то такі елементи відносять до s-елементів. У Періодичній системі клітинки з такими елементами зазвичай зафарбовують у червоний колір. Якщо останнім заповнюється р-підрівень, то такий елемент називають р-елементом, і його клітинку в Періодичній системі зафарбовують, як правило, у жовтий колір. d-Підрівень заповнюється в d-елементів (синій колір у Періодичній системі) і f-підрівень у f-елементів (зелений колір).
На кожному енергетичному рівні є s-підрівень, що максимально містить два електрони й серед інших підрівнів певного електронного шару завжди заповнюється першим. Це обумовлює те, що кожен період Періодичної системи починається з двох s-елементів.
Починаючи з другого енергетичного рівня, існує р-підрівень, що максимально містить шість електронів, адже й у кожному періоді, починаючи із другого, є по шість р-елементів. Так само кожен період, починаючи із четвертого, містить по десять d-елементів, а починаючи із шостого – ще по чотирнадцять f-елементів, які утворюють два сімейства елементів – лантаноїди та актиноїди.
У d – та f-елементів відбувається заповнення підрівнів не зовнішнього енергетичного рівня. Так, у d-елементів заповнюється передзовнішній d-підрівень (у d-елементів четвертого періоду, в яких зовнішнім є четвертий енергетичний рівень, заповнюється d-підрівень третього рівня – 3d, а в d-елементів п’ятого періоду заповнюється 4d-підрівень тощо).
Хімічні елементи, в атомах яких відбувається заповнення електронами передзовнішнього енергетичного рівня, називають перехідними.
У f-елементів електронами заповнюється передзовнішній f-підрівень: у f-елементів шостого періоду (лантаноїдів) електрони заселяють f-підрівень четвертого рівня (4f), а у f-елементів сьомого періоду (актиноїдів) – 5f.
Таким чином, порядок заповнення орбіталей в електронній оболонці атомів повністю відбивається на структурі Періодичної системи.
Будова електронних оболонок і групи Періодичної системи
Розгляньмо будову електронних оболонок атомів таких хімічних елементів: Літію, Натрію, Оксигену та Сульфуру. Після їх порівняння стає очевидним, що елементи однієї групи мають подібну електронну конфігурацію атомів. В атомах Літію й Натрію, які розташовані в першій групі Періодичної системи, на зовнішньому шарі міститься по одному електрону на s-орбіталях. Відмінність полягає тільки в тому, що в атомах Літію зовнішнім є другий енергетичний рівень, а в атомах Натрію – третій. Це стосується й атомів Оксигену та Сульфуру. Ці два елементи входять до шостої групи, й на зовнішніх рівнях їхніх атомів розташовано по шість електронів, які однаково розподілені по s – та р-підрівнях, адже ці дві пари елементів є електронними аналогами.
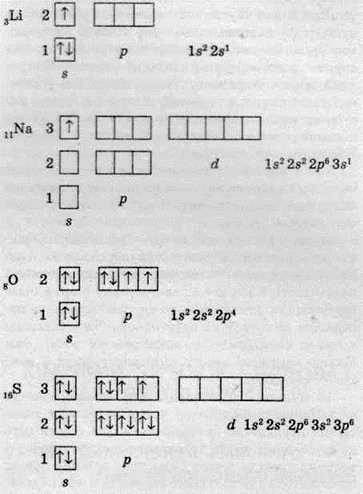
Якщо розглянути електронні конфігурації двох d-елементів однієї групи Періодичної системи, то ми побачимо таку саму подібність.
На підставі електронної будови атомів можна стверджувати, що подібність елементів однієї групи Періодичної системи, у першу чергу, обумовлюється електронною аналогією. Будова зовнішнього електронного шару атомів хімічних елементів, які входять до однієї підгрупи, подібна.
Розподіл елементів по головних та побічних підгрупах також обумовлюється будовою електронних оболонок. До головних підгруп входять тільки s – та р-елементи, в яких заповнюється зовнішній енергетичний рівень, а до побічних груп входять d-елементи, в яких заповнюється передзовнішній електронний шар.
