Електроліз водних розчинів електролітів – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ
§ 7.7. Електроліз водних розчинів електролітів
Слід розрізняти електроліз розплавлених електролітів і їх розчинів. В останньому випадку в процесах можуть брати участь молекули води.
Як приклад розглянемо електроліз концентрованого водного розчину хлориду натрію (електроди вугільні). В цьому разі у розчині перебувають гідратовані іони Na+ і Сl-, а також молекули води. Під час проходження струму
2Н2О + 2е – = Н2 + 2OН-, а на аноді окиснюються хлорид-іони:
2Сl – 2е – = Сl2.
В результаті на катоді виділятиметься водень, на аноді – хлор, а в розчині (поблизу катода) накопичуватиметься гідроксид натрію NaOH (негативні заряди іонів ОН – компенсуються позитивними зарядами іонів Na+ ). Загальне рівняння електролізу водного розчину NaCl в іонній формі
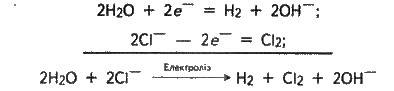
Або в молекулярній формі:

Катодні й анодні процеси. Як же відбувається відновний процес на катоді у водних розчинах?
1 У дуже розведених розчинах на аноді поряд з хлором може виділятися і кисень за рахунок окиснення молекули води:
2Н2) – 4е – = O2 + 2Н+.
Відповідь можна одержати за допомогою ряду стандартних електродних потенціалів (див. табл. 12.1). Тут можливі три випадки:
1) катіони металів, що мають більший стандартний електродний потенціал, ніж у гідрогену (від Си2+ до Аu3+), при електролізі практично повністю відновлюються на катоді;
2) катіони металів, що мають малі стандартні електродні потенціали (від Li+ до Аl3+ включно), не відновлюються на катоді, а замість них відновлюються молекули води;
3) катіони металів, що мають стандартний електродний потенціал менший, ніж у гідрогену, але більший, ніж у алюмінію(від Аl3+ до Н+), при електролізі на катоді відновлюються одночасно з молекулами води.
Якщо ж водний розчин містить катіони різних металів, то під час електролізу виділення їх на катоді відбувається в порядку зменшення алгебраїчної величини стандартного електродного потенціалу відповідного металу. Так, із суміші катіонів Ag+ , Cu2+, Fe2+ спочатку відновлюватимуться катіони аргентуму (E° = + 0,80 В), потім катіони купруму (Е° = + 0,34 В) і останніми – катіони феруму (E° = -0,44 В).
Характер реакцій, що відбуваються на аноді, залежить як від наявності молекул води, так і від речовини, з якої виготовлено анод. Звичайно аноди поділяють на нерозчинні і розчинні. Перші виготовляють з вугілля, графіту, платини, іридію; другі – з міді, срібла, цинку, кадмію, нікелю та інших металів.
На нерозчинному аноді в процесі електролізу відбувається окиснення аніонів або молекул води.
При цьому аніони безкисневих кислот (наприклад, S 2-, l-, Вr-, Сl-) при їх достатній концентрації легко окиснюються. Якщо ж розчин містить аніони кисневмісних кислот (наприклад, SO2-4, NO-3, СO2-3, РО3-4), то на аноді окиснюються не ці іони, а молекули води з виділенням кисню.
Розчинний анод під час електролізу сам піддається окисненню, тобто надсилає електрони в зовнішнє коло. При віддаванні електронів зміщується рівновага між електродом і розчином:
Me ⇆ Меn+ + ne-
Метал анода у розчин У зовнішнє коло
І анод розчиняється.
Приклади електролізу водних розчинів електролітів наведено в § 7.9.