Хімічні реакції. Окисно-відновні реакції
I СЕМЕСТР
ПОВТОРЕННЯ ОСНОВНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ (4 год.)
УРОК 4
Тема уроку. Хімічні реакції. Окисно-відновні реакції
Цілі уроку: актуалізувати знання учнів про хімічні реакції; удосконалювати вміння й навички складання повних і скорочених іонно-молекулярних та окисно-відновних рівнянь реакції; узагальнити уявлення учнів про швидкість хімічної реакції, хімічну рівновагу й фактори, що впливають на швидкість реакції та зсув хімічної рівноваги.
Тип уроку: повторення й систематизації знань.
Форми роботи: фронтальна,
Обладнання: періодична система хімічних елементів, ряд активності металів, таблиця розчинності, схема до уроку 4.
ХІД УРОКУ
I. Організація класу
II. Актуалізація опорних знань учнів з теми “Хімічні реакції. Окисно-відновні реакції”
Фронтальна бесіда за основними питаннями теми (з використанням схеми 4)
1. Класифікація реакцій
За якими ознаками класифікують хімічні реакції?
Хімічні реакції – це явища, за яких відбувається розрив одних і утворення інших хімічних зв’язків. При цьому з одних хімічних речовин утворюються інші речовини (або інша речовина).
За
1) Реакції, у результаті яких не відбувається зміни складу речовин:
А) алотропні перетворення:
С (графіт) 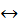 С (алмаз)
С (алмаз)
О2 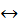 О3
О3
Б) реакції ізомеризації:
NH4OCN 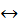 (NH2)2CO
(NH2)2CO
CH3 – CH2 – CH2 – CH3 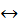 CH3 – СН(СН3) – CH3
CH3 – СН(СН3) – CH3
2) реакції, у результаті яких відбувається зміна складу речовин, – решта реакцій.
Назвіть типи реакцій за складом вихідних речовин і продуктів реакції.
А) реакції сполучення:
S + O2 = SO2
CaO + CO2 = CaCO3
C2H + Br2  C2H4Br2
C2H4Br2
Б) реакції розкладу:
2HgO = 2Hg + O2
MgCO3 = MgO + CO2
C2H5OH  C2H4 + H2O
C2H4 + H2O
В) реакції заміщення:
Zn + 2HCl = ZnCl2 + H2
CaCO3 + SiO2 = CaSiO3 + CO2
CH4 + Cl2  CH3Cl + HCl
CH3Cl + HCl
Г) реакції обміну:
CuO + H2SO4 = CuSO4 + H2O
NaOH + HCl = NaCl + H2O
HCOOH + CH3OH  HCOOCH3 + H2O
HCOOCH3 + H2O
Та інші, більш складні, реакції.
3) За зміною ступеня окиснення реакції поділяються на реакції, що протікають зі зміною ступеня окиснення (окисно-відновні реакції, ОВР):
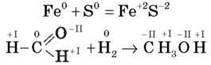
І реакції, що протікають без зміни ступеня окиснення.
Назвіть два типи реакцій за тепловим ефектом.
4) За зміною внутрішньої енергії (за тепловим ефектом реакції) реакції поділяються на такі:
А) екзотермічні:
2Mg + O2 = 2MgO + Q
CH4 + 2O2 = CO2 + 2H2O + Q
(тепло виділяється);
Б) ендотермічні:
CaCO3 = CaO + CO2 – Q
C8H18  C4H10 + C4H8 – Q
C4H10 + C4H8 – Q
(тепло поглинається).
5) За напрямом протікання реакції поділяються на такі:
А) необоротні:
AgNO3 + NaCl = AgCl + NaNO3
+ NaNO3
CH4 + Cl2 = CH3Cl + HCl
(протікають в одному напрямі);
Б) оборотні:
K2SO3 + H2O  KHSO3 + KOH
KHSO3 + KOH
C2H6  C2H4 + H2
C2H4 + H2
(протікають у двох напрямах).
6) За кількістю фаз у суміші реагентів розрізняють:
А) гомофазні реакції:
2CO(газ) + O2(газ) = 2CO2(газ)
(одна фаза – газ);
CH3NH2(розч.) + HCl(розч.) = [CH3NH3] Cl(розч.)
(одна фаза – водний розчин);
Б) гетерофазні реакції:
Fe(тв.) + CuSO4(розч.) = Cu(тв.) + FeSO4(розч.)
(три фази – дві тверді фази й водний розчин);
2Na(тв.) + 2C2H5OH(рід.) = 2C2H5ONa(розч.) + H2(газ)
(три фази – газ, тверда фаза і спиртовий розчин).
7) За участі в реакції каталізатора виокремлюють каталітичні реакції:
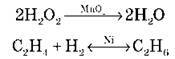
Існують також інші класифікаційні ознаки: швидкість, механізм та ін.
Ту саму реакцію за різними ознаками можна зарахувати одночасно до кількох типів. Охарактеризуйте реакцію одержання амоніаку за різними ознаками:
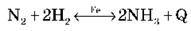
(Екзотермічна, оборотна, гомофазна (формально), каталітична, окисно-відновна реакція сполучення)
Реакції обміну, що протікають у розчинах, протікають до кінця, якщо утворюється осад, газ або малодисоційована речовина (зокрема, вода).
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
+ 2NaCl
NH4Cl + NaOH = NaCl + NH3 + H2O
+ H2O
KNO2 + HCl = KCl + HNO2 (молекулярне рівняння)
K+ + NO – + H+ + Cl – = K+ + Cl – + HNO2 (повне йонне рівняння)
H+ + NO – = HNO2 (скорочене іонне рівняння)
2. Швидкість хімічної реакції
Що таке швидкість хімічної реакції?
Швидкість гомофазної реакції – це відношення зміни концентрації реагенту або продукту реакції до часу протікання реакції.
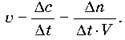
Одиниця вимірювання швидкості 1 моль/л-с.
Швидкість гетерофазної реакції – це відношення зміни кількості речовини реагенту або продукту реакції до часу протікання реакції та площі зіткнення реагентів.
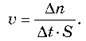
Одиниця вимірювання швидкості 1 моль/см2-с.
Назвіть фактори, що впливають на швидкість реакції.
1) Природа реагентів (склад, будова, енергія активації).
Енергія активації (Ea) – це надлишкова енергія (порівняно із середньою), необхідна для ефективного зіткнення часток реагентів.
Чим менша енергія активації, тим більша швидкість реакції, і чим більша енергія активації, тим менша швидкість реакції. Наприклад, реакції обміну у водних розчинах, що приводять до утворення осаду, протікають дуже швидко, тому що характеризуються дуже низькою енергією активації. Навпаки, реакція одержання амоніаку з водню й азоту за кімнатної температури практично не протікає, оскільки в неї дуже велика енергія активації.
2) Температура. У разі підвищення температури збільшується швидкість руху молекул і їх кінетична енергія, зменшується міцність зв’язків, усе це приводить до зростання числа частинок з енергією, що дорівнює енергії активації, та збільшення швидкості реакції.
3) Правило вант-Гоффа. У разі підвищення температури на 10 °С швидкість реакції зростає у 2-4 рази.
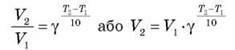
4) Концентрації реагентів. Чим більша концентрація реагентів, тим частіше їх частинки вдаряються одна об одну й тим більшою є швидкість реакції.
Для реакції aA + bB = dD, що протікає в одну стадію, швидкість реакції обчислюється за формулою: v = k – (cA)a – (cB)b. Цей вираз називається законом діючих мас для швидкості реакції. Стала (за постійної температури) величина k називається константою швидкості реакції. Вона дорівнює швидкості реакції за одиничних концентрацій реагентів.
Які речовини називаються каталізаторами?
5) Наявність каталізатора. Каталізатори – це речовини, з допомогою яких повільна реакція замінюється послідовністю більш швидких реакцій з меншими енергіями активації. Каталізатори вступають у першу реакцію цієї послідовності й виділяються в хімічно незмінній формі в результаті останньої реакції, тому створюється враження, що каталізатори підвищують швидкість реакції.
Інгібітори – це речовини, що зменшують швидкість реакції; інгібітори, на відміну від каталізаторів, під час реакції витрачаються.
6) Швидкість гетерофазних реакцій залежить також від стану поверхні (наприклад, чиста вона чи забруднена), характеру продуктів реакції (наприклад, розчинні вони чи ні), умов підведення реагентів і відведення продуктів реакції (наприклад, використовується перемішування чи ні).
Якщо реакція протікає на межі газової та твердої (або рідкої) фаз, то на швидкість реакції не впливають концентрації рідких і твердих речовин, а якщо на межі рідкої та твердої фаз – то концентрації твердих речовин.
3. Оборотні реакції. Хімічна рівновага Необоротні реакції протікають лише в одному напрямі.
Оборотні реакції – це реакції, які за тих самих умов протікають як у прямому, так і у зворотному напрямах.
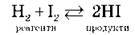
Стан оборотної реакції, за якого швидкість прямої реакції дорівнює швидкості зворотної реакції, називається хімічною рівновагою. Хімічна рівновага – це рівновага динамічна.
Принцип Ле Шательє: якщо на систему, що перебуває в рівновазі, вплинути зовні, то рівновага в системі зміститься в тому напрямі, у якому відбувається часткова компенсація цього впливу.
– У разі збільшення концентрації вихідної речовини рівновага зміщається в бік продуктів реакції;
– у разі збільшення концентрації продуктів реакції – у бік реагентів (вихідних речовин);
– унаслідок підвищення тиску (якщо в системі наявні гази) – у бік меншого об’єму;
– у разі зменшення тиску – у бік більшого об’єму;
– у результаті підвищення температури – у бік продуктів ендотермічної реакції;
– у разі зниження температури – у бік продуктів екзотермічної реакції.
Уведення каталізатора не зміщає рівноваги, але прискорює її досягнення.
4. Тепловий ефект реакції
Тепловий ефект реакції – це кількість теплоти, що виділяється або поглинається в процесі протікання реакції з тими кількостями речовини реагентів, що задаються коефіцієнтами в термохімічному рівнянні.
C2H4 + 3O2 = 2CO2 + 2H2O +1400 кДж (екзотермічна реакція)
CaCO3 = CaO + CO2 -157 кДж (ендотермічна реакція)
Тепловий ефект виникає насамперед через різницю в енергіях зв’язків у вихідних речовинах (реагентах) і продуктах реакції.
III. Керована практика
Завдання 1
1) З наведеного переліку випишіть екзотермічні й ендотермічні реакції:
А) 2NH3 = N2 + 3H2; ?H = +46,2 кДж
Б) C + O2 = CO2; ?H = -393 кДж
В) CH4 + 2O2 = CO2 + 2H2O + 890 кДж
Г) CaCO3 = CaO + CO2 -157 кДж
2) Наведіть приклади використання екзотермічних реакцій у життєдіяльності людини.
3) Складіть термохімічне рівняння реакції, якщо в результаті згоряння кальцію масою 4 г у кисні виділилося 63,6 кДж теплоти.
Завдання 2
1) Укажіть формулу обчислення швидкості реакції й одиниці її вимірювання:
А) V = ?S/?t;
Б) V = ?С/?t;
В) моль/л-с;
Г) км/год.
2) Визначте зміну концентрації реагентів, якщо за 30 секунд швидкість хімічної реакції склала 3,6 – 10-3 моль/л-с.
3) Доведіть на прикладах, що на швидкість реакції може впливати зміна площі зіткнення реагентів; зміна температури.
Завдання 3
1) Дано рівняння реакції:
2NO + O2 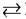 NO2 + Q
NO2 + Q
Укажіть фактори, що впливають на зсув хімічної рівноваги в бік прямої реакції:
А) підвищення тиску;
Б) підвищення температури;
В) зниження температури;
Г) зниження тиску;
Д) підвищення концентрації вихідних речовин.
Який принцип покладено в основу зсуву хімічної рівноваги?
2) Дано рівняння реакції:
2SO2 + O2 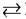 2SO3 + Q
2SO3 + Q
Як зміниться швидкість прямої реакції, якщо концентрацію SO2 в системі збільшити удвічі, а концентрацію O2 удвічі зменшити?
3) Поясніть своїм однокласникам принцип Ле Шательє на прикладах із життя.
Завдання 4. Уявіть собі реакцію:
1) Fe + CuCl2 = Cu + FeCl2
2) Fe + O2 = Fe2O3
А) Розставте в рівнянні коефіцієнти.
Б) Опишіть, які умови необхідно виконати, щоб реакція почалася, і завдяки чому ми побачимо, що вона протікає.
В) Запропонуйте прийоми прискорення цієї реакції.
Г) Поясніть на молекулярному рівні, чому в разі підвищення температури швидкість більшості реакцій зростає.
Д) як ми використовуємо в побуті вплив температури й тиску на швидкість хімічних реакцій?
Завдання 5. Покажіть, як зміститься рівновага в наведених нижче системах унаслідок зазначених змін зовнішніх умов.
1) Збільшили температуру:
A) CH4 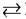 C + 2H2 – Q
C + 2H2 – Q
Б) CaCO3 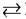 CaO + CO2 – Q
CaO + CO2 – Q
2) Підвищили температуру й концентрацію речовин, що вступили в реакцію:
А) SO2 + H2O 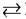 H2SO4
H2SO4
Б) CO2 + C 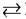 2CO – Q
2CO – Q
3) Зменшили тиск:
A) N2O4 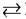 2NO2
2NO2
Б) 2NO + Cl2 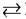 2NOCl2
2NOCl2
4) Поясніть, як агрегатний стан речовини може вплинути на зсув рівноваги оборотної реакції.
Завдання 6. Реакція за температури 40 °С протікає за 180 секунд. Температурний коефіцієнт реакції дорівнює 3. За скільки секунд завершиться ця реакція за температури 60 °С?
Завдання 7. Концентрація одного з реагентів через 20 секунд після початку реакції дорівнювала 0,1 моль/л, а через 30 секунд – 0,02 моль/л. Обчисліть середню швидкість цієї реакції.
Завдання 8. Підберіть коефіцієнти в схемах реакцій методом електронного балансу й укажіть окисник і відновник:
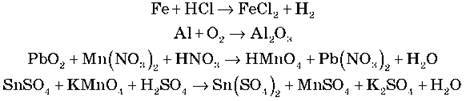
IV. Підбиття підсумків і висновки
Самостійна робота за варіантами
Варіант І
1. Підберіть коефіцієнти в схемах реакцій методом електронного балансу й укажіть окисник і відновник:
MnO2 + HCl  MnCl2 + Cl2 + H2O
MnCl2 + Cl2 + H2O
2. Обчисліть швидкість реакції, якщо відомо, що концентрація речовини змінилася від 0,5 моль/л до 0,2 моль/л за 20 секунд.
3. Унаслідок підвищення температури на 30 °С для реакції, температурний коефіцієнт якої дорівнює 3, швидкість реакцій збільшується:
А) у 3 рази;
Б) у 6 разів;
В) у 9 разів;
Г) у 27 разів.
Поясніть, як потрібно проводити обчислення.
Варіант ІІ
1. Підберіть коефіцієнти в схемах реакцій методом електронного балансу й укажіть окисник і відновник:
FeCl3 + KI  FeCl2 + І2 + KCl
FeCl2 + І2 + KCl
2. Обчисліть швидкість реакції, якщо відомо, що концентрація речовини змінилася від 0,15 моль/л до 0,10 моль/л за 30 секунд.
3. У разі підвищення температури на 20 °С для реакції, що має температурний коефіцієнт 2, швидкість реакції збільшиться:
А) у 2 рази;
Б) у 3 рази;
В) у 4 рази;
Г) у 6 разів.
Поясніть, як потрібно проводити обчислення.
V. Домашнє завдання
Повторити класи неорганічних сполук. Підготувати повідомлення про поширення неметалічних елементів у природі.
Додаток
Схема 4
За зміною складу речовин реакції
Не відбувається зміни | Відбувається зміна |
За зміною ступеня окиснення реакції
– реакції, що протікають зі зміною ступеня окиснення (окисно-відновні реакції, ОВР):
– реакції, що протікають без зміни ступеня окиснення.
За зміною внутрішньої енергії (за тепловим ефектом реакції) реакції
Екзотермічні: | Ендотермічні: |
За напрямом протікання реакції поділяються на
Необоротні: | Оборотні: |
За кількістю фаз у суміші реагентів розрізняють реакції
Гомофазні: | Гетерофазні: |
За участю в реакції каталізатора бувають реакції
Каталітичні: | Некаталітичні: |
Швидкість хімічної реакції
– гомофазної – 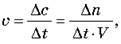 1 моль/л-с
1 моль/л-с
– гетерофазної – 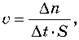 1 моль/см2-с
1 моль/см2-с
Фактори, що впливають на швидкість хімічної реакції
