Енергетика хімічних реакцій. Тепловий ефект реакції – Хімічна реакція
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
4. Хімічна реакція
4.4. Енергетика хімічних реакцій. Тепловий ефект реакції
Як відомо із закону збереження енергії, енергія не виникає з нічого і не зникає безслідно. Речовини, що вступають у хімічну реакцію (реагенти), мають певний запас енергії (внутрішньої енергії). Під час хімічної реакції руйнуються хімічні зв’язки у вихідних речовинах і утворюються нові зв’язки у продуктах реакції. Перетворення речовин приводить до зміни
Залежно від співвідношення цих величин у результаті реакції спостерігають виділення або поглинання енергії:
– якщо кількість енергії, що виділяється під час утворення хімічних зв’язків у продуктах, є більшою, ніж енергія, що витрачається на розрив хімічних зв’язків у реагентах, то спостерігають виділення енергії;
– якщо ж кількість енергії,
– кількість теплоти, що виділяється чи поглинається під час реакцій (при незмінному тиску), називають тепловим ефектом (ентальпією) реакції.
Позначають АН (читається “дельта аш”). Хімічні рівняння, в яких зазначено теплові ефекти реакцій, називають термохімічними, а розділ хімії, що вивчає теплові ефекти хімічних процесів, – термохімією.
Тепловий ефект реакції утворення одного моля будь-якої сполуки з простих речовин називають теплотою утворення ΔНутв. Теплоту утворення простих речовин вважають такою, що дорівнює нулю. Теплоту утворення сполуки, яку виміряно за стандартних умов, називають стандартною теплотою утворення або стандартною ентальпією утворення ΔНΘутв. Її визначають експериментально за допомогою спеціальних приладів (калориметрів) і зводять у таблиці.
Стандартна теплота утворення сполуки є важливою енергетичною характеристикою її стійкості:
– якщо ΔНΘутв < 0, речовина є стійкішою за прості речовини, з яких вона утворилась;
– якщо ΔНΘутв > 0, речовина є менш стійкою, ніж прості речовини, з яких вона утворилась;
– чим менше значення ΔНΘутв, тим більшою є термічна стійкість речовини, тобто її руйнування потребує більшої енергії.
У випадках, коли теплоту утворення визначити експериментально неможливо, для проведення термохімічних розрахунків користуються законом Гесса (1840): тепловий ефект реакції при постійних об’ємі або тиску (коли відсутня робота, не пов’язана з розширенням) не залежить від шляху реакції, а лише від початкового й кінцевого станів системи.
Виходячи із цього закону компоненти термохімічних реакцій можна додавати, множити на числові множники. Із закону Гесса витікає наслідок: тепловий ефект реакції ΔНР можна розрахувати як різницю між сумою теплот утворення продуктів реакції і сумою теплот утворення вихідних речовин ΔНΘутв:
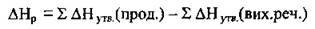
Це можна виразити графічно за допомогою енергетичних діаграм хімічних реакцій. Розглянемо два випадки перебігу оборотної реакції:
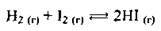
Реакція відбувається внаслідок розриву неполярних ковалентних зв’язків у молекулах водню і йоду. На це поглинається певна енергія (енергія розриву), яку називають енергією активації Еа, а частинки, які мають таку енергію – активними. Не кожне зіткнення між молекулами водню і йоду веде до утворення молекули йодоводню, а лише таке, у якому беруть участь активні частинки.
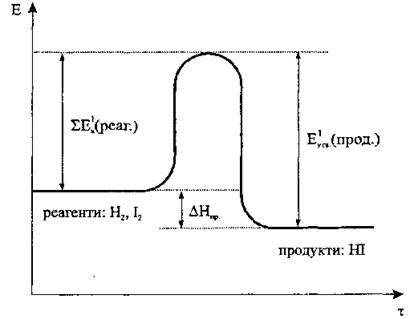
Рис. 1. Хід прямої реакції. ΔНпр. < 0
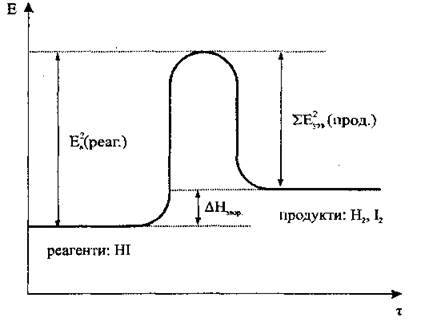
Рис. 2. Хід зворотної реакції. ΔНзвор > 0
Умовні позначення:
Σ Еа1 (реаг.) – сума енергій активації реагентів прямої реакції (Н2, І2);
Еа2 (реаг.) – енергія активації реагентів зворотної реакції (НІ);
Еутв.1 (прод.) – енергія утворення продуктів прямої реакції (НІ);
Σ Еа2 (реаг.) – сума енергій утворення продуктів зворотної реакції (Н2, І2);
ΔНпр.. – теплотою утворення продуктів прямої реакції (НІ);
ΔНзвор. – теплотою утворення продуктів зворотної реакції (Н2, І2).
При утворенні полярного ковалентного зв’язку у молекулі йодоводню НІ, навпаки, енергія виділяється (Еутв.). На рис. 1 показано, що Еа < Еутв., а тому під час прямої реакції водню з йодом енергія (у вигляді теплоти) виділяється. У зворотній реакції (рис. 2) Еа < Еутв., а тому енергія поглинається. Таким чином, за тепловим ефектом розрізняють:
– екзотермічні реакції – реакції, які супроводжуються виділенням теплоти (тепловий ефект екзотермічної реакції ΔН < 0):
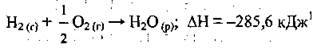
Реакції горіння, окиснення простих і складних речовин, взаємодія кислот з основами, як правило, є екзотермічними;
– ендотермічні реакції – це реакції, які супроводжуються поглинанням теплоти (ΔН > 0). До ендотермічних реакцій належить і реакція окиснення азоту:
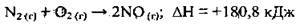
Реакції розкладу основ, солей та інших речовин, відновлення металів, як правило, є ендотермічними.
Тепловий ефект реакції є величиною, яка залежить від стехіометричних коефіцієнтів. Наприклад, термохімічне рівняння горіння аміаку в кисні:
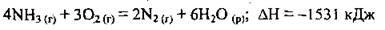
Означає, що на горіння 4 моль аміаку витрачається-3 моль кисню, а також утворюється 2 моль азоту, 6 моль води і при цьому виділяється 1532 кДж теплоти.