Ентальпія утворення сполук – Перетворення енергії в хімічних реакціях
ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ
1 . Перетворення енергії в хімічних реакціях
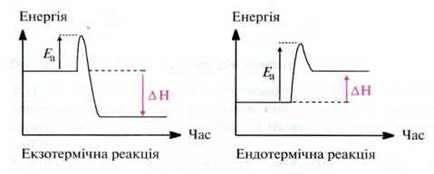
Практично в усіх хімічних реакціях відбувається взаємне перетворення різних видів енергії. Найчастіше енергія виділяється або поглинається у вигляді теплоти. Якщо в ході реакції енергія виділяється, то таку реакцію називають екзотермічною, якщо енергія поглинається, то таку реакцію називають ендотермічною реакцією.
Приклад. Магній реагує з киснем, утворюючи магній оксид. При цьому енергія виділяється у вигляді теплоти і світла:
Азот реагує з киснем, утворюючи нітроген(ІІ) оксид, лише поглинаючи енергію:
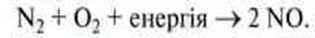
Більшість реакцій відбувається лише після активації реагентів. Потрібна для цього енергія активації Еа зазвичай використовується у вигляді теплоти.
1.1 . Ентальпія утворення сполук
Енергію, яка виділяється або поглинається при утворенні 1 моль сполуки з простих речовин, називають ентальпією утворення ∆Нf. Ентальпія утворення залежить від температури і тиску.
Якщо в ході реакції енергія виділяється, то ∆Нf < 0, а якщо поглинається, то ∆Нf > 0.
Приклад. При
Ентальпія утворення нітроген(ІІ) оксиду за тих самих умов складає ∆Н0f,298 = + 90 кДж/моль, тобто для утворення 1 моль нітроген(ІІ) оксиду з простих речовин поглинається 90 кДж.
Температура Т = 298,16 К і тиск р = 101,3 кПа є стандартними умовами, відповідну ентальпію утворення називають стандартною ентальпією утворення ∆Н0f,298.
Увага: стандартні умови не слід плутати з нормальними умовами: ТН = 273,16 К (= 0 °С) і рн = 101,3 кПа.
Related posts:
- Ентальпія утворення простих речовин – Перетворення енергії в хімічних реакціях ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 1 . Перетворення енергії в хімічних реакціях 1.2 . Ентальпія утворення простих речовин Прості речовини складаються з атомів одного виду, які залежно від агрегатного стану і виду простих речовин з’єднуються між собою по-різному. Утворення молекул або іонів з окремих атомів, кристалічних граток з іонів або молекул енергія кристалічної гратки, також пов’язане з […]...
- Ентальпія реакції – Перетворення енергії в хімічних реакціях ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 1 . Перетворення енергії в хімічних реакціях 1.3 . Ентальпія реакції Енергію, що виділилася або була поглинута в ході хімічної реакції, називають ентальпією реакції ∆HR або тепловим ефектом реакції. Значення цієї енергії легко визначити, якщо відомі ентальпії утворення ∆Hf відповідних речовин, що беруть участь у реакції. Тепловим ефектом реакції є різниця енергії […]...
- Енергія в проміжних реакціях – Перетворення енергії в хімічних реакціях ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 1 . Перетворення енергії в хімічних реакціях 1.4 . Енергія в проміжних реакціях Часто зустрічаються реакції, зміну енергії яких експериментально важко або взагалі неможливо визначити. Проте непрямим шляхом ця проблема вирішується: – шукана реакція поділяється на низку проміжних стадій, ентальпія реакцій яких відома; – шукана реакція є однією з проміжних реакцій, сума […]...
- Стандартні ентальпія утворення й ентропія іонів у водних розчинах ДОДАТОК 3. Термодинамічні величини простих речовин і сполук. Стандартна ентальпія утворення ∆ Н f, 2 98 º I Ентропія S 298 º Стандартні ентальпія утворення й ентропія іонів у водних розчинах Іон (ag) ∆Нf,298º КДж/моль S298 º Дж/(моль ∙ К) Іон (ag) ∆Нf,298º КДж/моль S298 º Дж/(моль ∙ К) Ag+ 106 73 Cu+ 72 41 […]...
- Ентальпія гідратації іонів при 25 °С ДОДАТОК 3. Термодинамічні величини простих речовин і сполук. Стандартна ентальпія утворення ∆ Н f, 2 98 º I Ентропія S 298 º Ентальпія гідратації ∆ H 0 гідр. іонів при 25 °С Іон ∆ H0гідр. КДж/моль Іон ∆ H0гідр. КДж/моль Іон ∆ H0гідр. КДж/моль Ag+ -489,53 F- -485,34 MnO4- -246,86 Ba2+ -1338,88 H+ -1108,76 NH4+ […]...
- Ентальпія кристалічної гратки твердих речовин при 25 °С у кДж/моль ДОДАТОК 3. Термодинамічні величини простих речовин і сполук. Стандартна ентальпія утворення ∆ Н f, 2 98 º I Ентропія S 298 º Ентальпія кристалічної гратки ∆ H 0 кр. гр. твердих речовин при 25 °С у кДж/моль F Cl Br J O S Li -1028 -848 -803 -752 Na -916 -788 -744 -698 – – […]...
- ЕНЕРГІЯ ГІББСА. УТВОРЕННЯ РЕЧОВИНИ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ЕНЕРГІЯ ГІББСА. УТВОРЕННЯ РЕЧОВИНИ Стандартною молярною енергією Гіббса утворення речовини ΔG°УТB<298 називають зміну енергії Гіббса при утворенні 1 моль речовини з простих речовин у стандартних умовах. Стандартна молярна енергія Гіббса утворення простої речовини, стійкої у стандартних умовах, дорівнює нулю. Одиниця виміру енергії Гіббса утворення речовини – […]...
- Вільна енергія реакції Гіббса – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.4. Вільна енергія реакції Гіббса Кожна реакція характеризується двома тенденціями: – система речовин прагне перейти у стан з якомога меншою ентальпією; – система речовин прагне перейти в стан з якомога більшою ентропією. Тому реакція Проходить самочинно в той бік, де знижується ентальпія реакції і зростає її ентропія. […]...
- Внутрішня енергія кристалічних речовин – Зміна енергії при кристалізації і розчиненні ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 2 . Зміна енергії при кристалізації і розчиненні У твердому агрегатному стані речовини утворюють, як правило, гратку, в якій частинки впорядковано сполучені між собою. Взаємодія між іонами обумовлена кулонівськими силами, між молекулами – вандерваальсовими силами. 2.1. Внутрішня енергія кристалічних речовин Утворення кристалічної гратки зі складових частинок – це екзотермічний процес. Енергію, яка […]...
- Ентропія простих речовин і сполук – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.2 . Ентропія простих речовин і сполук Прийнято вважати, що атоми елементів і сполук при абсолютному нулі (тобто при 0 К або -273,16 °С) знаходяться в абсолютно впорядкованому стані. Ентропія речовин при абсолютному нулі становить S = 0 Дж/(моль ∙ К). При підвищенні температури порядок у структурі […]...
- Теплота розчинення – Зміна енергії при кристалізації і розчиненні ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 2 . Зміна енергії при кристалізації і розчиненні 2.2 . Теплота розчинення Розчинення твердих речовин у розчиннику і розчинення рідин, що змішуються між собою, завжди пов’язане зі зміною енергії. Процес розчинення супроводжується нагріванням (виділенням енергії) або охолоджуванням (поглинанням енергії), залежно від речовин, які беруть у цьому участь. Енергію, що виділяється або поглинається […]...
- Енергетика хімічних реакцій. Тепловий ефект реакції – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.4. Енергетика хімічних реакцій. Тепловий ефект реакції Як відомо із закону збереження енергії, енергія не виникає з нічого і не зникає безслідно. Речовини, що вступають у хімічну реакцію (реагенти), мають певний запас енергії (внутрішньої енергії). Під час хімічної реакції руйнуються […]...
- Рівняння хімічних реакцій. Закон збереження маси речовин у хімічних реакціях Контрольні запитання № 1. Маси речовин, що вступають у реакцію, дорівнюють масі утворених речовин, про що свідчить закон збереження маси в хімічних реакціях. Цей закон підкріплений тим, що атоми в хімічних реакціях не зникають, а просто переходять з одних речовин до складу інших. За допомогою хімічних символів і знаків закон збереження маси відображають рівнянням хімічної […]...
- Об’ємні відношення газів у хімічних реакціях. Закон Авогадро Хімія Загальна хімія Основні поняття, закони й теорії хімії Об’ємні відношення газів у хімічних реакціях. Закон Авогадро Закон об’ємних відношень Гей-Люссака Гази реагують між собою у певних об’ємних відношеннях. У 1808 р. Ж. Л. Гей-Люссак установив таку закономірність: Об’єми газів, що вступають у реакцію, відносяться один до одного і до газоподібних продуктів реакції як невеликі […]...
- Швидкість хімічних реакцій ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.1. Швидкість хімічних реакцій Суть хімічних реакцій зводиться до розриву зв’язків у вихідних речовинах і виникнення нових зв’язків у продуктах реакції. При цьому загальне число атомів кожного елемента до і після реакції залишається сталим. Оскільки утворення […]...
- ОБМІН РЕЧОВИН ТА ПЕРЕТВОРЕННЯ ЕНЕРГІЇ В КЛІТИНІ Біологія – універсальний довідник ЗАГАЛЬНА БІОЛОГІЯ ОСНОВИ ЦИТОЛОГІЇ ОБМІН РЕЧОВИН ТА ПЕРЕТВОРЕННЯ ЕНЕРГІЇ В КЛІТИНІ Основою життєдіяльності клітини є обмін речовин і перетворення енергії. Обмін речовин – сукупність всіх реакцій синтезу та розпаду, що проходять в організмі і характеризуються виділенням або поглинанням енергії. Обмін речовин та енергії являє собою два взаємозалежних і протилежних процеси: асиміляцію […]...
- ЗАКОН ГЕССА. РОЗРАХУНОК ЕНТАЛЬПІЇ ХІМІЧНОЇ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ЗАКОН ГЕССА. РОЗРАХУНОК ЕНТАЛЬПІЇ ХІМІЧНОЇ РЕАКЦІЇ Тепловий ефект реакції залежить від початкового і кінцевого станів системи і не залежить від шляху реакції (закон Гесса). Наприклад: Кількість теплоти, яка виділяється під час спалювання метану СН4, не залежить від того, протікає реакція за одну стадію чи за дві […]...
- ПОЛОЖЕННЯ ЕЛЕМЕНТІВ У ПЕРІОДИЧНІЙ СИСТЕМІ Д. І. МЕНДЕЛЄЄВА І СТРУКТУРА УТВОРЕННЯ НИМИ ПРОСТИХ РЕЧОВИН – КРИСТАЛИ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ КРИСТАЛИ ПОЛОЖЕННЯ ЕЛЕМЕНТІВ У ПЕРІОДИЧНІЙ СИСТЕМІ Д. І. МЕНДЕЛЄЄВА І СТРУКТУРА УТВОРЕННЯ НИМИ ПРОСТИХ РЕЧОВИН Будова простих речовин визначається числом валентних електронів (рис. 24). Рис. 24. Моделі будови простих речовин елементів третього періоду: Аргон Аr – молекула одноатомна; Хлор Сl2 – молекула двохатомна; Сірка S8 – молекула восьмиатомна; Сірка […]...
- Елементи ДОДАТОК 3. Термодинамічні величини простих речовин і сполук. Стандартна ентальпія утворення ∆ Н f, 2 98 º I Ентропія S 298 º Елементи Речовина ∆Нf,298º КДж/моль S298 º Дж/(моль ∙ К) Речовина ∆Нf,298º КДж/моль S298 º Дж/(моль ∙ К) Ag 0 42,69 J2(газоподібн. ig) 62,24 260,58 Al 0 28,31 К 0 64,25 Br2 (рідк.) 0 […]...
- ОБМІН РЕЧОВИН І ПЕРЕТВОРЕННЯ ЕНЕРГІЇ Природні та штучні системи в середовищі життя людини Тема 1. Організм як жива система §5. ОБМІН РЕЧОВИН І ПЕРЕТВОРЕННЯ ЕНЕРГІЇ Ви знаєте, що речовини бувають неорганічні, наприклад вода, кисень, вуглекислий газ, та органічні, як-от: білки, жири, вуглеводи. Ці речовини організми отримують під час живлення. Отже, завдяки живленню організми забезпечують себе речовинами, необхідними для побудови тіла. […]...
- Класифікація за тепловим ефектом – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Класифікація за тепловим ефектом За тепловим ефектом реакції належать або до екзотермічних (реакції з виділенням теплоти) або до ендотермічних (реакції з поглинанням теплоти). Тепловий ефект хімічної реакції. Термохімічні рівняння Велика кількість хімічних процесів відбувається з виділенням енергії, […]...
- Тема 16. Оксиди – ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Тема 16. Оксиди Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Вкажіть ряд речовин, в якому наведено лише кислотні оксиди: A. К2O, МgО, Fе2O3; Б. Аl2O3, SiO2, NO2; B. SO2, SO3, СO2; Г. N2O, СО, СаО. […]...
- Співвідношення об’ємів газів у хімічних реакціях. Обчислення об’ємних співвідношень газів за хімічними рівняннями Тема 3 НАЙВАЖЛИВІШІ ОРГАНІЧНІ СПОЛУКИ Урок 38 Тема уроку. Співвідношення об’ємів газів у хімічних реакціях. Обчислення об’ємних співвідношень газів за хімічними рівняннями Цілі уроку: формувати знання учнів про закон об’ємних співвідношень для газоподібних речовин на прикладі хімічних реакцій органічних речовин; формувати вміння застосовувати закон об’ємних співвідношень для розрахунків за хімічними рівняннями. Тип уроку: формування нових […]...
- УТВОРЕННЯ ХІМІЧНОГО ЗВ’ЯЗКУ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ХІМІЧНИЙ ЗВ’ЯЗОК УТВОРЕННЯ ХІМІЧНОГО ЗВ’ЯЗКУ Хімічний зв’язок здійснюється за рахунок електростатичної взаємодії позитивно заряджених атомних ядер і негативно заряджених електронів. Під час утворення хімічних сполук з атомів виділяється енергія....
- ЕНЕРГІЯ. ПЕРЕТВОРЕННЯ ЕНЕРГІЇ Тема З РУКОТВОРНІ СИСТЕМИ § 24. ЕНЕРГІЯ. ПЕРЕТВОРЕННЯ ЕНЕРГІЇ Енергія. Ви, напевне, чули вислів “енергійна людина”. Так називають людей, здатних активно виконувати роботу. Проте не тільки люди здатні виконувати роботу. Вода, що падає з греблі, виконує роботу – обертає турбіни електростанції, вітер обертає лопаті вітряка. Тобто рухомі вода і повітря виконують роботу, отже, вони мають […]...
- КРУГООБІГ РЕЧОВИН І ПЕРЕТВОРЕННЯ ЕНЕРГІЇ У БІОСФЕРІ Довідник з біології ЗАГАЛЬНА БІОЛОГІЯ ЛЮДИНА І БІОСФЕРА КРУГООБІГ РЕЧОВИН І ПЕРЕТВОРЕННЯ ЕНЕРГІЇ У БІОСФЕРІ Головна функція біосфери полягає в забезпеченні кругообігів хімічних елементів. Глобальний біотичний кругообіг здійснюється за участю всіх організмів, що населяють планету. Він полягає в циркуляції речовин між грунтом, атмосферою, гідросферою і живими організмами. Завдяки біотичному кругообігу можливе тривале існування й розвиток […]...
- СИЛИ ТА ПЕРЕТВОРЕННЯ ЕНЕРГІЇ В ДОВКІЛЛІ Тема З РУКОТВОРНІ СИСТЕМИ § 26. СИЛИ ТА ПЕРЕТВОРЕННЯ ЕНЕРГІЇ В ДОВКІЛЛІ Урок серед природи Мета уроку: ознайомитися з дією сил та перетворенням енергії. Прилади і матеріали: бінокль, ручка, зошит для записів. Хід уроку 1. У яких явищах природи проявляється сила земного тяжіння? Чому хмари не падають на землю? Чому рухається вода в струмках? Чому […]...
- Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів. Визначення валентності за формулами бінарних сполук ТЕМА 1. ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ Урок 6. Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів. Визначення валентності за формулами бінарних сполук Цілі: сформувати поняття про валентність, одиницю валентності, навчити учнів визначати валентність елементів у бінарних сполуках, складати формули сполук за валентністю; розвивати логічне мислення та творчі здібності. Обладнання: періодична таблиця елементів. Тип уроку: […]...
- Зв’язок між класами неорганічних сполук – НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 6. НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК § 6.6. Зв’язок між класами неорганічних сполук Між простими речовинами, оксидами, кислотами, основами і солями існує генетичний зв’язок, а саме – можливість їх взаємного переходу. Наприклад, проста речовина метал кальцій внаслідок сполучення його з киснем перетворюється […]...
- Тести – Урок 6 – Основні класи неорганічних сполук ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 7. Основні класи неорганічних сполук Тести 7.1 Установіть відповідність між хімічними формулами речовин та класами неорганічних сполук Формула: Клас сполук: 1 Сr(ОН)3 А оксид 2 В2О3 Б кислота 3 KHSO3 В кисла сіль 4 HNO2 Г сіль Д основа 7.2 Установіть відповідність між […]...