ФЕРМЕНТИ І БІОЛОГІЧНИЙ КАТАЛІЗ
Розділ 2 Молекулярний рівень організації живої природи
Тема 5. Біомолекулярний склад живого
§ 24. ФЕРМЕНТИ І БІОЛОГІЧНИЙ КАТАЛІЗ
Терміни та поняття: каталізатор, ензим, апофермент, кофермент, вітамін, субстрат, оксидоредуктази, трансферази, гідролази, ліази, активний центр ферменту, фермент-субстратний комплекс, активатори, інгібітори, ціаніди, цитохромоксидази.
Історична довідка. Група простих або складних білків, які виконують функцію біологічних каталізаторів (від грец. каталізис – руйнування), називається ферментами. Цей

Мал. 124. Л. Пастер
Всередині і зиме – закваска), вживана нині переважно в англійській і французькій мовах, з’явилась у науковій літературі значно пізніше – лише наприкінці ХІХ ст. Слід зазначити, що трохи більше ста років тому терміни фермент і ензим, які зараз є синонімами, відображали різне розуміння вченими природи хімічних перетворень, що відбуваються в організмах, зокрема спиртового бродіння. Великий
Будова і класифікація ферментів. Звичайно фермент складається з двох частин: білкової – апофермен – ту (від лат. апо – без чогось і фермент) та небілкової – коферменту (від лат. ко – разом і фермент). Роль останнього в одних ферментах виконують спеціальні низькомолекулярні речовини – вітаміни, в інших – іони металів або деякі сполуки. Білкова частина ферменту може мати третинну або четвертинну структуру. Це викликано тим, що ферменти, які складаються з кількох білкових субодиниць, мають більшу специфічність дії. У будь-якій клітині міститься кілька сотень видів ферментів, кожний з яких каталізує певну реакцію, впливаючи на конкретну речовину – субстрат (від лат. субстратум – основа).
Спочатку назви ферментам давали за випадковими асоціаціями, які виникали у їх першовідкривачів. Наприклад, фермент пепсин (мал. 126) отримав цілком логічну назву від грецького слова пепсис – травлення, а інший травний фермент – трипсин чомусь від трипсис – розріджую. В подальшому назви ферментам давали у відповідності до того, на який субстрат впливає фермент. Фермент, який розщеплює полісахарид амілозу до молекул глюкози, назвали амілазою (мал. 127), а фермент, що руйнує зв’язки молекул ортофосфатної кислоти з іншими молекулами, – фосфатазою.

Мал. 125. Е. Бухнер
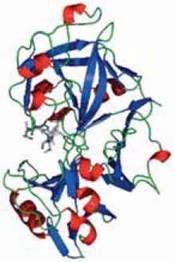
Мал. 126.Комп’ютерна модель просторової будови молекул пепсину
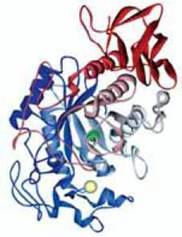
Мал. 127. Комп’ютерна модель просторової структури амілази
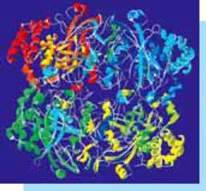
Мал. 128. Модель каталази еритроцитів людини
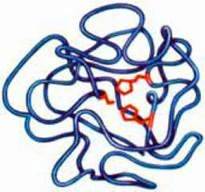
Мал. 129. Просторова модель хімотрипсину. Червоним кольором позначено активний центр
В основу сучасної класифікації ферментів покладено кілька ознак, зокрема, на який субстрат діє фермент, яку реакцію він каталізує і, якщо ця реакція обумовлена переносом активних груп з однієї молекули на іншу, то в назві зазначається сполука, до якої ця група транспортується. Відповідно до Міжнародної комісії з номенклатури кожний фермент має власний номер – шифр. Всього виділяють шість класів ферментів.
Оксидоредуктази каталізують реакції окиснення чи відновлення. До цих ферментів належать кілька дуже важливих: каталаза (мал. 128), яка каталізує розклад гідроген пероксиду, що постійно утворюється в клітинах, до води і кисню; лактатдегідрогеназа каталізує окиснення молочної кислоти до піровиноградної, алкогольдегідрогеназа окиснює спирти до альдегідів. Вважається, що саме генетично обумовлений дефіцит останнього ферменту є причиною нездатності переносити спиртні напої окремими особами.
Трансферази каталізують перенесення певних груп атомів з однієї молекули субстрату на іншу. Серед ферментів цього класу особливе значення мають фосфотрансферази, які транспортують фосфатну групу з однієї молекули на іншу.
Гідролази каталізують реакції гідролізу (амілаза, фосфатаза, пепсин, трипсин).
Ліази каталізують розрив хімічних зв’язків у молекулі субстрату, який не приводить до гідролізу. В результаті лінійні молекули можуть переходити в кільцеві, або замість одинарного зв’язку буде утворюватися подвійний (дезамінази).
Ізомерази каталізують просторові зміни в структурі молекули субстрату, тобто перетворюють один ізомер на інший.
Лігази каталізують утворення хімічних зв’язків між субстратами за рахунок гідролізу енергозберігаючих молекул. Типовим прикладом є ДНК-полімераза, за допомогою якої утворюються молекули ДНК.
Яким чином відбувається біологічний каталіз. Основою життєдіяльності кожного організму є величезна кількість взаємопов’язаних хімічних реакцій, перебіг яких відбувається миттєво. Цю надзвичайну швидкість перетворень одних речовин на інші забезпечують ферменти. Це їх головна функція. Підраховано, що ферменти здатні прискорювати хімічні реакції у мільйони і мільярди разів. Хімічні реакції, які відбуваються у клітинах за частки секунди, за звичайних умов тривають роками. Так, розчин сахарози за кімнатної температури може протягом кількох років зберігатися без жодних змін, а після додавання ферменту сахарази цей дисахарид розкладеться на молекули глюкози і фруктози за кілька хвилин. Щоб досягти подібного ефекту іншим шляхом, потрібно сильно нагріти розчин і додати до нього хлоридну чи сульфатну кислоту. (Пригадайте їх формули.) Зазвичай це неможливо зробити в живій клітині, тому цю роботу виконують ферменти.
Яким чином ферменти прискорюють хімічні реакції без підвищення температури й отримання енергії ззовні? У молекулі ферменту міститься група особливо активних амінокислот, які утворюють активний центр ферменту (мал. 129), здатного швидко взаємодіяти лише з відповідною речовиною – субстратом (мал. 130). При цьому субстрат є специфічним для певного ферменту і підходить, як за своєю структурою, так і фізико-хімічними властивостями до активного центру “як ключ до замка”, а тому перебіг реакції субстрату з активним центром здійснюється миттєво. Унаслідок реакції виникає фермент-субстратний комплекс, який потім легко розпадається, утворюючи вже нові продукти. Речовини, що утворилися, враз відокремлюються від ферменту, який відновлює свою структуру і стає здатним знову здійснювати ту саму реакцію. За секунду фермент реагує з мільйонами молекул субстрату і сам при цьому не руйнується.
Завдяки ферменту біохімічні реакції можливі при дуже незначній концентрації речовини у клітині, що надзвичайно важливо, особливо в тих випадках, коли за допомогою ферментів організм позбавляється шкідливих речовин. Вже відомий вам фермент каталаза за одну секунду руйнує стільки ж молекул гідроген пероксиду, скільки за звичайних умов протягом 300 років.
Властивості ферментів. Кожний фермент каталізує лише певну реакцію. Слід зазначити, що він не визначає самої можливості реакції, а тільки прискорює її в мільйони разів, роблячи її швидкість “космічною”. Подальше перетворення речовини, що утворилася внаслідок однієї ферментативної реакції, здійснює другий фермент, далі третій і т. д. У клітинах тварин і рослин містяться тисячі різних ферментів, тому вони не просто прискорюють тисячі хімічних реакцій, а й контролюють їхній перебіг.
Швидкість дії ферменту залежить від температури (найефективніша – близько +40 °С) і певних значень рН розчину, специфічного для конкретного ферменту. Для більшості ферментів значення рН лежить в межах від 6,6 до 8,0, хоча є і винятки. (Пригадайте, при яких значеннях рН найкраще діють ті чи інші травні ферменти.)
Підвищення температури до +50 °С призводить до руйнування активного центру ферменту і він на завжди втрачає можливість виконувати свої функції. Це зумовлено тим, що відбувається необоротне порушення третинної структури білка, і після охолодження молекула ферменту не відновлює своєї структури. Саме цим пояснюється, чому навіть нетривалий вплив високої температури вбиває живі істоти. Проте існують організми, ферменти яких пристосувалися до високих температур. Наприклад, в Африці в гарячих джерелах з температурою води близько +60 °С живе і розмножується представник класу ракоподібних термосбена дивовижна, а деякі бактерії живуть навіть у водоймах, де температура води понад +70 °С.
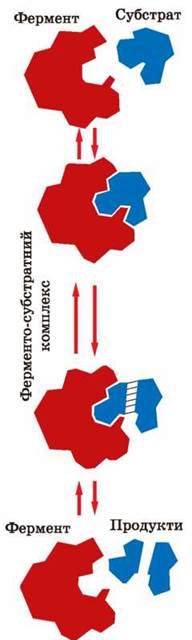
Мал. 130.Схема взаємодії ферменту з субстратом
Руйнування структури ферменту можуть спричинити отрути, що потрапляють до організму навіть у дуже незначній кількості. Ці речовини, які називаються інгібіторами (від лат. інгібіо – стримую), необоротно сполучаються з активним центром ферменту і таким чином блокують його діяльність.
Однією з найсильніших отрут, як відомо, є ціаніди (солі синільної кислоти НСК), що блокують роботу дихального ферменту цитохромоксидази. Тому навіть незначна кількість цієї речовини, потрапивши до організму, спричинює смерть від задухи. Інгібіторами є йони важких металів (Hg2+, Pb2+), а також сполуки Арсену, які утворюють сполуки з амінокислотами, що входять до активного центру ферменту.
Крім інгібіторів ферментів, існують і активатори (від лат. активус – діяльний), які значно підсилюють дію ферментів, а деякі “включають” ферменти. Одним із найбільш поширених активаторів є йони Mg2+.
Слід наголосити, що ферменти можуть бути отрутою. Зокрема, отрута змій – це концентрат ферментів, які під час укусу потрапляють до кровоносної системи і починають швидко руйнувати речовини, з яких складаються клітини й тканини організму, або блокують роботу нервової системи.
Використання ферментів у практичній діяльності людини. При деяких захворюваннях у крові людини з’являються ферменти, яких немає в здоровому організмі. За наявністю чи підвищеною активністю цих ферментів за допомогою спеціальних кольорових реакцій можна не тільки діагностувати хворобу, але й визначити ступінь її важкості й контролювати перебіг. Відомо, наприклад, що при різноманітних ураженнях печінки в крові різко підвищується активність фосфатаз.
Ферменти як лікарські препарати успішно використовують у медицині. Завдяки ферментним препаратам можна значно покращити травлення, загоїти рани, врятуватися від гнійних процесів, позбутися післяопераційних фляків і спайок.
За допомогою ферментів генно-інженерними засобами “у пробірці” одержують багато біологічно активних речовин, а також лікарських препаратів. Ферменти використовують у виноробстві й пивоварстві, при обробці шкір, у хлібопекарській і хімічній промисловості.
Ферменти – біологічні каталізатори, без участі яких не відбувається жоден життєвий процес. Вони характеризуються здатністю: реагувати з певною речовиною – субстратом; прискорювати біохімічні реакції, які зазвичай йдуть дуже повільно; діяти при дуже незначних концентраціях субстрату, при цьому не потребуючи надходження енергії ззовні; функціонувати залежно від температури і рН середовища.
Біологічний каталіз відзначається надзвичайно високою ефективністю і здатністю ферментів чітко вирізняти речовину, з якою вони взаємодіють.