ФУНКЦІЇ БІЛКІВ
РОЗДІЛ 1. МОЛЕКУЛЯРНИЙ РІВЕНЬ ОРГАНІЗАЦІЇ ЖИТТЯ
ТЕМА 2. ОРГАНІЧНІ РЕЧОВИНИ
§ 10 . ФУНКЦІЇ БІЛКІВ
Пригадайте: що ви знаєте про органели, ендосперм, хромосоми, антитіла та
Антигени? Що таке катіони та аніони? Які сполуки відносять до глікопротеїдів? Які клітини належать до еукаріотичних?
Ви вже знаєте, наскільки різноманітними можуть бути білкові молекули. А різноманітність білкових молекул, у свою чергу, визначає різноманітність їхніх функцій.
– Будівельна, або структурна, функція полягає в тому, що білки є складовим компонентом
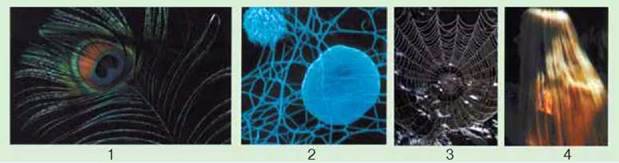
Мал. 10.1. Структури, до складу яких входить білок: 1 – борідки пера птаха; 2 – кров’яний згусток (тромб);
3 – павутиння; 4 – волосся людини
Головним компонентом хрящів і сухожилків є пружний і міцний білок колаген. Волокна цього білка є й в інших різновидах тканин внутрішнього середовища.
– Енергетична функція білків полягає в тому, що за повного розщеплення 1 г білків у середньому вивільняється 17,2 кДж енергії.
– Захисна функція білків. Структури, до складу яких входять білки (зовнішній скелет членистоногих, кістки, хрящові утвори), запобігають ушкодженню клітин, органів й організму в цілому. Білки захищають організми від проникнення ззовні сторонніх сполук і хвороботворних мікроорганізмів. Імуноглобуліни (або антитіла) хребетних тварин – спеціалізовані білки, здатні “розпізнавати” та знешкоджувати бактерії, віруси та інші – антигени. Це сполуки, які організм сприймає як чужорідні і зумовлюють специфічну імунну відповідь. Імуноглобулінам притаманна специфічність – певне антитіло утворюється у відповідь на надходження в організм того чи іншого антигену. Інтерферон – це білок, який пригнічує розмноження вірусів. На його основі створено лікувальні противірусні препарати. Білки крові (пригадайте, які) беруть участь у процесах її зсідання та утворення тромбів, запобігаючи крововтратам при ушкодженні стінок кровоносних судин. Захисну функцію можуть виконувати деякі ферменти, наприклад лізоцим, який міститься у слині, слизових оболонках, слізній рідині та знешкоджує різних хвороботворних агентів.
– Сигнальна функція білків полягає в тому, що окремі складні білки (глікопротеїди) клітинних мембран здатні “розпізнавати” специфічні хімічні сполуки і певним чином на них реагувати. Зв’язуючи їх або змінюючи свою структуру, вони тим самим передають сигнали про ці речовини на інші ділянки мембрани або всередину клітини. Ця функція білків забезпечує важливу властивість клітин – подразливість.
– Скорочувальна, або рухова, функція. Деякі білки забезпечують здатність клітин, тканин чи цілого організму змінювати форму, рухатись. Наприклад, білки актин і міозин, які входять до складу м’язових клітин, забезпечують їхню здатність до скорочення. Білок тубулін входить до складу мікротрубочок, джгутиків і війок клітин еукаріотів.
– Резервна функція. Деякі білки, які відкладаються про запас, можуть слугувати запасом поживних речовин для організму. Так, білки відкладаються про запас в яйцеклітинах тварин, клітинах ендосперму рослин. Ці білки зародок споживає на перших етапах свого розвитку.
– Ще одна з основних функцій білків – транспортна. Пригадайте, гемоглобін та інші подібні до нього забарвлені сполуки – дихальні пігменти крові людини і багатоклітинних тварин. Їхні молекули здатні утворювати нестійкі сполуки з киснем або вуглекислим газом і завдяки руху крові та інших рідин організмів транспортувати ці речовини, забезпечуючи процеси клітинного та тканинного дихання.
Крім того, гемоглобін дає змогу зберігати резерв Оксигену в організмі у зв’язаному стані. Це має важливе значення для тварин – мешканців багатих на органіку водойм за умов дефіциту кисню (личинки комарів-дергунів – мотиль, малощетинкові черви – трубочники тощо).
Транспортні білки переносять ліпіди, що синтезуються на мембранах ендоплазматичної сітки, до інших органел. Білки, вбудовані в плазматичну мембрану, забезпечують транспорт речовин у клітину та з клітини назовні.
– Функція протистояння несприятливим температурам. У плазмі крові деяких риб містяться білки, що запобігають її замерзанню в умовах низьких температур. Натомість, в організмів, які мешкають у гарячих джерелах, є білки, що не денатурують навіть за температури +50…90 °С.
– Багато білків виконують регуляторну функцію. Білкову природу мають певні гормони та нейрогормони, які регулюють активність обміну речовин, процеси росту і розвитку організмів (наприклад, гормон росту).
– Каталітична функція притаманна особливим білкам – ферментам, або ензимам, що впливають на перебіг біохімічних реакцій. Каталіз (від грец. каталіз – припинення) – зміна швидкості перебігу хімічних реакцій під дією певних хімічних сполук. Каталітичну функцію в живих організмах – біокаталіз – здійснюють ферменти (мал. 10.2).
Ферменти бувають простими та складними. Прості ферменти – це білкові молекули (пепсин, трипсин тощо), які складаються лише з амінокислотних залишків. Складні ферменти, крім білкової частини, містять ще й небілкову, яку називають кофактором. Кофакторами можуть бути неорганічні катіони або аніони, а також органічні речовини (коферменти), наприклад похідні вітамінів. Білковий компонент складних ферментів визначає, яку саме реакцію каталізує певний складний фермент. Але активність складних ферментів проявляється лише тоді, коли білкова частина ферменту сполучається з небілковою.
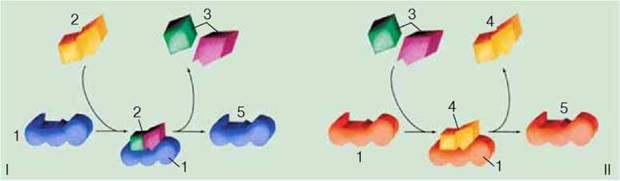
Мал. 10.2. Функції ферментів. І. Фермент (1) тимчасово сполучається з речовиною (2) і забезпечує її розщеплення на простіші сполуки (3). ІІ. Фермент (1) вступає у тимчасовий комплекс із двома молекулами (3) і забезпечує їхню реакцію з утворенням складнішої речовини (4). Після реакції структура ферменту не змінюється (5) і він готовий забезпечувати нові реакції
Каталітична активність ферменту зумовлена не всією його молекулою, а лише її невеликою ділянкою – активним центром. Його просторова структура відповідає хімічній будові речовин, які вступають у реакцію. Активний центр відповідає за приєднання та перетворення сполук, що вступають у реакцію. Саме тому дія ферменту специфічна. Часто до складу активного центру входять похідні вітамінів або атоми металів. В одній молекулі ферменту може бути кілька активних центрів.
Ферменти утворюють нестійкі комплекси з речовинами, які вступають у реакцію. Ферментативна реакція перебігає в 106-1012 разів швидше, ніж у середовищі без ферментів. За кілька секунд чи навіть частки секунди в організмі відбувається складна послідовність реакцій, для проведення якої із застосуванням звичайних хімічних каталізаторів потрібні дні, тижні або навіть місяці та роки. Це пояснюють тим, що для здійснення будь-якої хімічної реакції необхідний контакт між реагентами. Аби відбулася реакція без участі ферментів, потрібна висока концентрація реагуючих речовин у середовищі або підвищена температура, за якої прискорюється рух молекул і зростає ймовірність контактів молекул реагуючих сполук. Але в організмах концентрація речовин часто дуже низька, а високі температури можуть бути небезпечними. Саме тому біохімічні реакції не можуть відбуватися без участі ферментів.
При контакті з ферментом речовина, що вступає в реакцію, орієнтується у безпосередній близькості від специфічних груп активного центру ферменту. При цьому зменшується стабільність хімічних зв’язків у її молекулі. Відомо, що для перебігу хімічної реакції молекула субстрату повинна перейти у так званий перехідний стан, коли полегшується розрив хімічних зв’язків. Енергію, необхідну для переходу субстрату в активований стан, називають енергією активації (на розрив певного зв’язку витрачається енергії не менше, ніж витрачено на його утворення). Іншими словами, енергія активації – це енергія, потрібна для того, щоб розпочалася відповідна хімічна реакція. Утворюючи комплекс “фермент-речовини, які вступають у реакцію”, ферменти знижують енергію активації. Такий комплекс швидко розпадається з утворенням продуктів реакції. Сам фермент при цьому не втрачає своєї активності і може каталізувати наступну подібну реакцію.
Одні ферменти забезпечують розщеплення певних сполук, інші – синтез. Наприклад, фермент целюлаза забезпечує розщеплення клітковини (целюлози). Якщо в реакції беруть участь дві сполуки або більше, кожна з них взаємодіє з ферментом. Фермент при цьому утримує їх близько одна від одної, забезпечуючи реакцію.
Активність ферменту проявляється лише за певних умов: тих чи інших значень температури, тиску, рН тощо. Існують і спеціальні речовини, здатні регулювати активність ферментів. Вони зв’язуються з активними центрами ферментів і блокують їхню активність. У ролі таких речовин – інгібіторів можуть виступати йони важких металів: Плюмбуму (Pb), Арсену (As), Аргентуму (Ag).
Ферментативні реакції відбуваються у вигляді низки послідовних етапів (до декількох десятків). Ланцюги взаємопов’язаних ферментативних реакцій загалом забезпечують обмін речовин і перетворення енергії в окремих клітинах й організмі в цілому.
Ферменти мають певне розташування як у межах окремої клітини, так і в організмі в цілому. У клітині багато ферментів пов’язані з плазматичною мембраною або мембранами окремих органел (мітохондрій, пластид тощо).
Ключові терміни та поняття. Ферменти, біокаталіз, кофактор.
Коротко про головне
Різноманітні білкові молекули в живих організмах здійснюють функції:
– будівельну, або структурну (складові клітинних мембран та інших структур клітини, хрящів, сухожилків, кісток тощо);
– енергетичну (при повному розщепленні 1 г білків у середньому звільняється 17,2 кДж енергії);
– захисну (імуноглобуліни, інтерферон, лізоцим, участь у процесах зсідання крові);
– сигнальну (білки клітинних мембран здатні “розпізнавати” специфічні хімічні сполуки або дію різних чинників і певним чином на них реагувати, забезпечуючи подразливість клітин);
– скорочувальну, або рухову (деякі білки забезпечують здатність клітин, тканин чи цілого організму змінювати форму, рухатись);
– резервну (деякі білки можуть слугувати запасом поживних речовин для організму);
– транспортну (дихальні пігменти крові тварин; білки, вбудовані в плазматичну мембрану);
– протистояння занадто низьким або високим температурам довкілля;
– регуляторну (гормони та нейрогормони);
– каталітичну (ферменти, або ензими, що впливають на швидкість біохімічних реакцій).
Прості ферменти становлять собою білкові молекули, які складаються лише з амінокислотних залишків. Складні ферменти, крім білкової частини, містять і небілкову – кофактор. Ферментативна реакція перебігає в 106-1012 разів швидше, ніж у середовищі без ферментів.