Класифікація хімічних реакцій – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ
Класифікація хімічних реакцій
Класифікація за числом та складом вихідних реагентів і продуктів реакції
Реакція сполучення – реакція, внаслідок якої з кількох речовин з відносно простим складом утворюється одна велика речовина з більш складною структурою.
А + В + С = D.
Як правило, такі реакції супроводжуються виділенням тепла. Найбільш характерні реакції сполучення для взаємодії простих
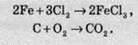
Також вони характерні й для складних сполук. Наприклад, для реакцій взаємодії оксидів з водою або основним оксидом з кислотним.
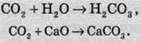
Реакції розкладу призводять до утворення кількох речовин з однієї складної речовини:
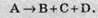
Продуктами реакції розкладу можуть бути як складні речовини, так і прості:
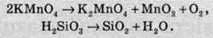
У реакціях заміщення атом одного елемента заміщає атом або групу атомів у складній сполуці:

У реакціях заміщення зазвичай одна проста речовина реагує зі складною
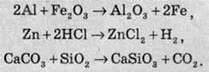
До реакцій обміну належать реакції, в яких дві сполуки обмінюються своїми складовими частинами (атомами або групами атомів):
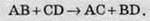
Це найпоширеніша група реакцій між склад ними речовинами, зокрема, між кислотами, основами та оксидами.
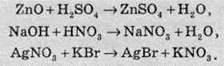
Зазвичай ці реакції відбуваються тоді, коли в результаті утворюється газувата речовина, осад або малодисоціювальна речовина, зокрема вода.
Класифікація за числом фаз, в яких перебувають учасники реакцій
Реагенти, що беруть участь у хімічній реакції, можуть перебувати в однакових агрегатних станах та різних. Залежно від того, чи існує між реагентами межа поділу, реакції поділяють на дві групи.
Гомогенні реакції. До них належать реакції між газуватими речовинами або між розчиненими речовинами.
Гетерогенні реакції. До них належать реакції, в яких реагенти перебувають у різних фазах (тобто між речовинами існує межа поділу). Наприклад:
Реакції між газом та рідиною:
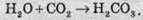
Реакції між газами й твердими речовинами:
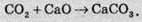
Реакції між твердими речовинами й рідинами (розчинами):
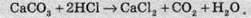
Класифікації за можливістю протікання реакції в прямому й зворотному напрямках
Оборотними називають реакції, продукти яких здатні реагувати один з одним у тих самих умовах, в яких вони отримані, з утворенням вихідних речовин. Наприклад, при нагріванні йодоводню до температури 500 °С 24% його розпадається на йод та водень: 2НІ → Н2 + І2.
Якщо ж у тому самому просторі нагріти однакові кількості йоду й водню до 500 °С, то 76 % їх сполучаються й утворюють йодоводень:
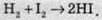
Для оборотних реакцій у рівнянні прийнято записувати замість знака рівності двонаправлену стрілку. Цим підкреслюють, що в тих самих умовах проходить як пряма реакція, так і оборотна.
Необоротними називають такі хімічні процеси, продукти яких не здатні реагувати один з одним з утворенням вихідних речовин. Прикладами необоротних реакцій можуть слугувати реакції розкладу калій перманганату при нагріванні:
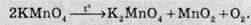
Органічні реакції в більшості випадків є оборотними, на відміну від неорганічних.